Författare:
Frank Hunt
Skapelsedatum:
16 Mars 2021
Uppdatera Datum:
27 Juni 2024
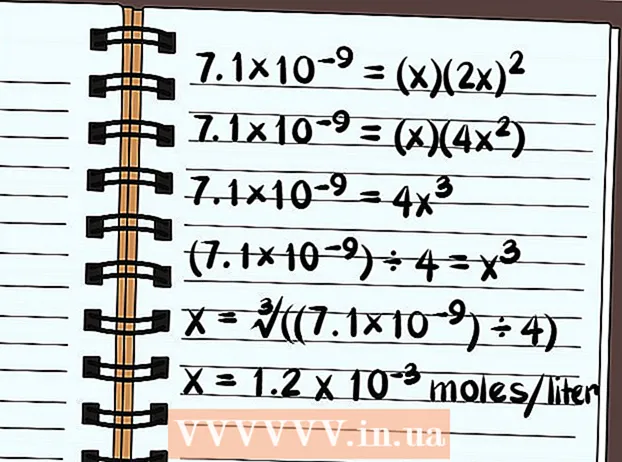
Innehåll
- Att gå
- Metod 1 av 2: Använda snabba regler
- Metod 2 av 2: Beräkning av lösligheten av K.sp
- Förnödenheter
- Tips
- Varningar
I kemi används löslighet för att beskriva egenskaperna hos ett fast ämne som blandas med och löses fullständigt i en vätska utan att lämna olösta partiklar. Endast (laddade) jonföreningar är lösliga. För praktiska ändamål är det tillräckligt att memorera några regler eller konsultera en lista med regler för att berätta om de flesta jonföreningar kommer att förbli fasta när de blandas med vatten, eller om en betydande mängd kommer att lösas upp. I verkligheten kommer vissa molekyler att lösas upp även om du inte ser några förändringar, så för exakta experiment måste du veta hur du beräknar denna mängd.
Att gå
Metod 1 av 2: Använda snabba regler
 Lär dig mer om jonföreningar. Varje atom har normalt ett antal elektroner, men ibland vinner eller förlorar de en extra elektron. Resultatet är ett Jon med en elektrisk laddning. När en jon med en negativ laddning (en extra elektron) möter en jon med en positiv laddning (en elektron saknas), binder de ihop, precis som de negativa och positiva ändarna av två magneter. Resultatet är en jonbindning.
Lär dig mer om jonföreningar. Varje atom har normalt ett antal elektroner, men ibland vinner eller förlorar de en extra elektron. Resultatet är ett Jon med en elektrisk laddning. När en jon med en negativ laddning (en extra elektron) möter en jon med en positiv laddning (en elektron saknas), binder de ihop, precis som de negativa och positiva ändarna av två magneter. Resultatet är en jonbindning. - Joner med negativ laddning anropas anjoneroch joner med en positiv laddning katjoner.
- Normalt är antalet elektroner i en atom lika med antalet protoner, där de elektriska laddningarna är i jämvikt.
 Känn löslighet. Vattenmolekyler (H.2O) har en ovanlig struktur, med vilken de beter sig som en magnet: ena änden har en positiv laddning medan den andra änden är negativt laddad. När du blandar en jonbindning med vatten kommer dessa "vattenmagneter" att samlas runt den och försöka dra isär de positiva och negativa jonerna. Vissa jonbindningar är inte särskilt täta ihop; dessa är lösligeftersom vatten kommer att riva och lösa upp bindningen. Andra kompositer har starkare bindningar och är Ej lösbareftersom de kan hålla ihop trots vattenmolekylerna.
Känn löslighet. Vattenmolekyler (H.2O) har en ovanlig struktur, med vilken de beter sig som en magnet: ena änden har en positiv laddning medan den andra änden är negativt laddad. När du blandar en jonbindning med vatten kommer dessa "vattenmagneter" att samlas runt den och försöka dra isär de positiva och negativa jonerna. Vissa jonbindningar är inte särskilt täta ihop; dessa är lösligeftersom vatten kommer att riva och lösa upp bindningen. Andra kompositer har starkare bindningar och är Ej lösbareftersom de kan hålla ihop trots vattenmolekylerna. - Vissa anslutningar har inre bindningar som är jämförbara i styrka med vattenets drag. Dessa ämnen är måttligt löslig, eftersom en betydande del (men inte alla) av obligationerna kommer att dras isär.
 Studera reglerna för löslighet. Eftersom interaktionen mellan atomer är ganska komplex är det inte alltid intuitivt vilka föreningar som är lösliga och olösliga. Hitta den första jonen i föreningen i listan nedan för att ta reda på hur den brukar fungera, kontrollera sedan undantagen för att se till att den andra jonen inte interagerar onormalt.
Studera reglerna för löslighet. Eftersom interaktionen mellan atomer är ganska komplex är det inte alltid intuitivt vilka föreningar som är lösliga och olösliga. Hitta den första jonen i föreningen i listan nedan för att ta reda på hur den brukar fungera, kontrollera sedan undantagen för att se till att den andra jonen inte interagerar onormalt. - Till exempel att använda strontiumklorid (SrCl2), sök efter Sr eller Cl i de djärva stegen som anges nedan. Cl är "mest lösbar" så kolla efter undantag nedan. Sr anges inte som ett undantag, så SrCl2 vara löslig.
- De vanligaste undantagen från varje regel listas nedan. Det finns andra undantag, men du kommer förmodligen inte hitta dem i en vanlig kemiklass eller lab.
 Föreningar är lösliga när de innehåller alkalimetaller, inklusive Li, Na, K, Rb och Cs. Dessa kallas också elementen i grupp IA: litium, natrium, kalium, rubidium och cesium. Nästan vilken förening som helst med någon av dessa joner är löslig.
Föreningar är lösliga när de innehåller alkalimetaller, inklusive Li, Na, K, Rb och Cs. Dessa kallas också elementen i grupp IA: litium, natrium, kalium, rubidium och cesium. Nästan vilken förening som helst med någon av dessa joner är löslig. - Undantag: Li3PO4 är inte löslig.
 Föreningar med NO3, C2H.3O2, NEJ2, ClO3 och ClO4 är lösliga. Dessa är nitrat-, acetat-, nitrit-, klorat- och perkloratjoner. Observera att acetat ofta förkortas med OAc.
Föreningar med NO3, C2H.3O2, NEJ2, ClO3 och ClO4 är lösliga. Dessa är nitrat-, acetat-, nitrit-, klorat- och perkloratjoner. Observera att acetat ofta förkortas med OAc. - Undantag: Ag (OAc) (silveracetat) och Hg (OAc)2 (kvicksilveracetat) är inte lösliga.
- AgNO2 och KClO4 är endast "delvis lösliga".
 föreningar med Cl, Br och I är vanligtvis lösliga. Klorid-, bromid- och jodidjoner bildar nästan alltid lösliga föreningar, även kända som halogensalter.
föreningar med Cl, Br och I är vanligtvis lösliga. Klorid-, bromid- och jodidjoner bildar nästan alltid lösliga föreningar, även kända som halogensalter. - Undantag: Om någon av dessa binder med joner av silver (Ag), kvicksilver (Hg2) eller bly (Pb), är resultatet inte lösligt. Detsamma gäller för de mindre vanliga föreningarna med koppar (Cu) och tallium (Tl).
 Anslutningar till SO4 är vanligtvis lösliga. Sulfatjonen bildar vanligtvis lösliga föreningar, men det finns flera undantag.
Anslutningar till SO4 är vanligtvis lösliga. Sulfatjonen bildar vanligtvis lösliga föreningar, men det finns flera undantag. - Undantag: Sulfatjonen bildar olösliga föreningar med följande joner: strontium Sr, barium Ba, bly Pb, silver Ag, kalcium Ca, radium Ra och diatomiskt silver Ag2. Observera att silversulfat och kalciumsulfat löses upp tillräckligt för att ibland kallas lite lösligt.
 Föreningar med OH eller S är inte lösliga. Dessa är hydroxid respektive sulfidjoner.
Föreningar med OH eller S är inte lösliga. Dessa är hydroxid respektive sulfidjoner. - Undantag: Kommer du ihåg alkalimetallerna (grupp I-A) och hur mycket de gillar att bilda olösliga föreningar? Li, Na, K, Rb och Cs bildar alla lösliga föreningar med hydroxid- eller sulfidjoner. Dessutom bildar hydroxid lösliga salter med jordalkalimetaller (grupp II-A) joner: kalcium Ca, strontium Sr och barium Ba. Observera att hydroxiden med jordalkaliska föreningar har tillräckligt med molekyler för att hålla sig ihop för att ibland betraktas som "sparsamt lösliga".
 Föreningar med CO3 eller PO4 är inte lösliga. Kontrollera en sista gång för karbonat- och fosfatjoner, och du borde veta vad du kan förvänta dig av föreningen.
Föreningar med CO3 eller PO4 är inte lösliga. Kontrollera en sista gång för karbonat- och fosfatjoner, och du borde veta vad du kan förvänta dig av föreningen. - Undantag: Dessa joner bildar lösliga föreningar med de vanliga substanserna, alkalimetallerna Li, Na, K, Rb och Cs, liksom med ammonium NH4.
Metod 2 av 2: Beräkning av lösligheten av K.sp
 Leta upp löslighetsprodukten för konstant K.sp. Denna konstant skiljer sig åt för varje anslutning, så du måste slå upp den i en tabell i din lärobok eller online. Eftersom dessa värden bestäms experimentellt kan de variera mycket från tabell till tabell, så det är bäst att använda tabellen i din lärobok, om det finns en. Om inte annat anges antar de flesta tabeller en omgivningstemperatur på 25o C.
Leta upp löslighetsprodukten för konstant K.sp. Denna konstant skiljer sig åt för varje anslutning, så du måste slå upp den i en tabell i din lärobok eller online. Eftersom dessa värden bestäms experimentellt kan de variera mycket från tabell till tabell, så det är bäst att använda tabellen i din lärobok, om det finns en. Om inte annat anges antar de flesta tabeller en omgivningstemperatur på 25o C. - Till exempel om du vill lösa blyjodid (PbI2), skriv ner jämviktskonstanten för löslighetsprodukten. Om du använder en tabell på bilbo.chm.uri.edu, använd konstant 7.1 × 10.
 Skriv först ner den kemiska ekvationen. Bestäm först hur föreningen bryts ner till joner när den löses upp. Skriv nu en ekvation med K.sp å ena sidan och de enskilda jonerna å andra sidan.
Skriv först ner den kemiska ekvationen. Bestäm först hur föreningen bryts ner till joner när den löses upp. Skriv nu en ekvation med K.sp å ena sidan och de enskilda jonerna å andra sidan. - Till exempel en PbI-molekyl2 delas i jonerna Pb, I och en annan I (du behöver bara veta eller slå upp laddningen för en jon, för du vet att den totala föreningen alltid har en neutral laddning).
- Skriv ekvationen 7.1 × 10 = [Pb] [I]
 Justera ekvationen för att använda variabler. Skriv om ekvationen som ett enda algebra-problem med din kunskap om antalet molekyler eller joner. Ställ in x lika med mängden ämne som kommer att lösas upp och skriv om variablerna som antalet för varje jon i termer av x.
Justera ekvationen för att använda variabler. Skriv om ekvationen som ett enda algebra-problem med din kunskap om antalet molekyler eller joner. Ställ in x lika med mängden ämne som kommer att lösas upp och skriv om variablerna som antalet för varje jon i termer av x. - I vårt exempel skriver vi om 7.1 × 10 = [Pb] [I]
- Eftersom det bara finns en blyjon (Pb) i föreningen kommer antalet upplösta föreningsmolekyler att vara lika med antalet fria blyjoner. Så vi kan ersätta [Pb] med x.
- Eftersom det finns två jodjoner (I) för varje blyjon kan vi jämföra antalet jodatomer till 2x.
- Ekvationen läser nu 7,1 × 10 = (x) (2x)
 Tänk på vanliga joner, om några. Hoppa över detta steg om du löser upp föreningen i rent vatten. Om föreningen upplöses i en lösning som redan innehåller en eller flera av de ingående jonerna (en "gemensam jon") minskas lösligheten avsevärt. Effekten av de vanliga jonerna är mest märkbar i föreningar som oftast är olösliga, och i dessa fall kan det antas att den stora majoriteten av jonerna vid jämvikt kommer från den jon som redan finns i lösningen. Skriv om ekvationen med den kända molära koncentrationen (mol per liter eller M) av jonerna som redan finns i lösningen, och ersätt värdet på x som du använde för den jonen.
Tänk på vanliga joner, om några. Hoppa över detta steg om du löser upp föreningen i rent vatten. Om föreningen upplöses i en lösning som redan innehåller en eller flera av de ingående jonerna (en "gemensam jon") minskas lösligheten avsevärt. Effekten av de vanliga jonerna är mest märkbar i föreningar som oftast är olösliga, och i dessa fall kan det antas att den stora majoriteten av jonerna vid jämvikt kommer från den jon som redan finns i lösningen. Skriv om ekvationen med den kända molära koncentrationen (mol per liter eller M) av jonerna som redan finns i lösningen, och ersätt värdet på x som du använde för den jonen. - Till exempel, om vår blyjodförening löstes i en lösning innehållande 0,2 M blyklorid (PbCl2), då kan vi skriva om ekvationen som 7.1 × 10 = (0.2M + x) (2x). Och då, eftersom 0,2 M är en så högre koncentration än x, kan vi säkert skriva om detta som 7,1 × 10 = (0,2 M) (2x).
 Lös ekvationen. Lös för x och vet hur löslig föreningen är. På grund av hur löslighetskonstanten definieras kommer ditt svar att uttryckas som antalet mol av den upplösta föreningen per liter vatten. Du kan behöva en miniräknare för att hitta det slutliga svaret.
Lös ekvationen. Lös för x och vet hur löslig föreningen är. På grund av hur löslighetskonstanten definieras kommer ditt svar att uttryckas som antalet mol av den upplösta föreningen per liter vatten. Du kan behöva en miniräknare för att hitta det slutliga svaret. - Följande gäller löslighet i rent vatten, inte med några vanliga joner.
- 7,1 × 10 = (x) (2x)
- 7.1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 mol per liter löses upp. Detta är en mycket liten mängd, så du vet att denna förening i princip är dåligt löslig.
Förnödenheter
- Tabell över konstanter för löslighetsprodukter (K.sp) för anslutningar.
Tips
- Om du har data från experiment om i vilken grad en förening löses upp kan du använda samma ekvation för att lösa löslighetskonstanten Ksp.
Varningar
- Det finns ingen allmänt accepterad definition av dessa termer, men kemister är överens om majoriteten av föreningarna. Några marginella fall beträffande föreningarna med en betydande andel av upplösta och olösta molekyler kan beskrivas med olika löslighetstabeller.
- Vissa äldre läroböcker ger NH4OH igen som en löslig komposition. Detta är felaktigt; små mängder NH4 och OH-joner kan observeras, men kan inte isoleras för att bilda en förening.



