Författare:
Helen Garcia
Skapelsedatum:
17 April 2021
Uppdatera Datum:
1 Juli 2024
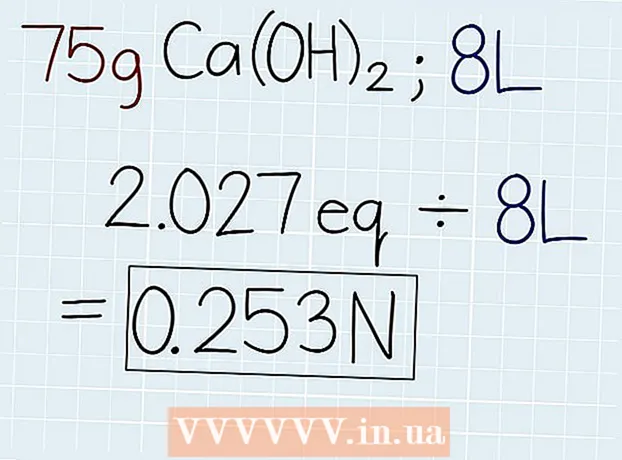
Innehåll
- Steg
- Metod 1 av 2: Beräkning av normalitet via molaritet
- Metod 2 av 2: Beräkning av normalitet i ekvivalent massa
- Tips
- Vad behöver du
Normalitet indikerar koncentrationen av syra eller alkali i en lösning. För att ta reda på normaliteten hos en lösning kan både molaritet och molekylens ekvivalenta massa användas i beräkningarna. Om du väljer att använda molaritet, använd formeln N = M (n), där M är molaritet och n är antalet väte- eller hydroxidmolekyler. Om du bestämmer dig för att använda ekvivalentmassan använder du formeln N = eq ÷ V, där eq är antalet ekvivalenter och V är lösningens volym.
Steg
Metod 1 av 2: Beräkning av normalitet via molaritet
 1 Tillsätt molmassan av alla komponenter i lösningen. Hitta elementen i den kemiska formeln på det periodiska systemet för att ta reda på deras atommassa, som motsvarar molmassan. Skriv ner molmassan för varje element och multiplicera det med antalet element. Lägg till molmassan för alla komponenter för att hitta den totala molmassan.
1 Tillsätt molmassan av alla komponenter i lösningen. Hitta elementen i den kemiska formeln på det periodiska systemet för att ta reda på deras atommassa, som motsvarar molmassan. Skriv ner molmassan för varje element och multiplicera det med antalet element. Lägg till molmassan för alla komponenter för att hitta den totala molmassan. - Till exempel, om du vill veta den molära massan av svavelsyra (H2SÅ4), ta reda på molmassan av väte (1 g), svavel (3 g) och syre (16 g).
- Multiplicera massan med antalet komponenter i kompositionen. I vårt exempel finns det 2 väteatomer och 4 syreatomer. Den totala molmassan av väte är 2 x 1 g = 2 g. Molmassan av syre i denna lösning kommer att vara 4 x 16 g = 64 g.
- Tillsätt alla molmassor. Du får 2 g + 32 g + 64 g = 98 g / mol.
- Om du redan känner till molariteten i lösningen du letar efter, gå direkt till steg 4.
 2 Dela lösningens faktiska massa med molmassan. Ta reda på lösningens faktiska vikt. Det kommer att anges antingen på behållaren med lösningen eller i själva uppgiften.Dela sedan lösningens massa med den totala molmassan som hittades tidigare. Resultatet blir antalet mol i lösningen, varefter "mol" ska skrivas.
2 Dela lösningens faktiska massa med molmassan. Ta reda på lösningens faktiska vikt. Det kommer att anges antingen på behållaren med lösningen eller i själva uppgiften.Dela sedan lösningens massa med den totala molmassan som hittades tidigare. Resultatet blir antalet mol i lösningen, varefter "mol" ska skrivas. - Till exempel, om du försöker ta reda på normaliteten av 100 g H2SÅ4upplöst i 12 liter vätska, använd den verkliga massan och dela med molar. Som ett resultat får du: 100 g ÷ 98 g / mol = 1,02 mol.
- 1 mol är lika med 6,02 x 10 atomer eller molekyler av en lösning.
 3 Dela resultatet med volymen av lösningen i liter för att ta reda på molariteten. Ta antalet mol i lösningen som just beräknats och dividera den med den totala volymen av lösningen som ska mätas. Som ett resultat kommer du att känna molariteten (M), med vilken du kan ta reda på koncentrationen av lösningen.
3 Dela resultatet med volymen av lösningen i liter för att ta reda på molariteten. Ta antalet mol i lösningen som just beräknats och dividera den med den totala volymen av lösningen som ska mätas. Som ett resultat kommer du att känna molariteten (M), med vilken du kan ta reda på koncentrationen av lösningen. - Baserat på vårt exempel får vi följande formel: 1,02 mol ÷ 12 L = 0,085 M.
Råd: var noga med att omvandla lösningsvolymen till liter om du inte redan har gjort det. Annars får du fel svar.
 4 Multiplicera molaritet med antalet väte- eller hydroxidmolekyler. Ta en titt på den kemiska formeln för att ta reda på antalet väteatomer (H) i en syra eller hydroxidmolekyler i (OH) i basen. Multiplicera sedan lösningens molaritet med antalet väte- eller hydroxidmolekyler i lösningen för att hitta den normala koncentrationen eller normaliteten. I slutet av ditt svar skriver du förkortningen "N".
4 Multiplicera molaritet med antalet väte- eller hydroxidmolekyler. Ta en titt på den kemiska formeln för att ta reda på antalet väteatomer (H) i en syra eller hydroxidmolekyler i (OH) i basen. Multiplicera sedan lösningens molaritet med antalet väte- eller hydroxidmolekyler i lösningen för att hitta den normala koncentrationen eller normaliteten. I slutet av ditt svar skriver du förkortningen "N". - I vårt exempel är svavelsyra (H2SÅ4) 2 väteatomer. Så formeln kommer att vara så här: 0,085 M x 2 = 0,17 N.
- I ett annat exempel har natriumhydroxid (NaOH) med en molaritet på 2 M endast 1 hydroxidmolekyl. Därför kommer formeln att vara följande: 2 M x 1 = 2 N.
Metod 2 av 2: Beräkning av normalitet i ekvivalent massa
 1 Ta reda på lösningens totala molmassa. Ta en titt på lösningens kemiska formel och hitta varje element i det periodiska systemet. Skriv ner molmassan för varje element och multiplicera det med antalet element i formeln. Lägg till alla molmassor för att hitta den totala molmassan i gram.
1 Ta reda på lösningens totala molmassa. Ta en titt på lösningens kemiska formel och hitta varje element i det periodiska systemet. Skriv ner molmassan för varje element och multiplicera det med antalet element i formeln. Lägg till alla molmassor för att hitta den totala molmassan i gram. - Till exempel, om du vill veta molmassan av Ca (OH)2, ta sedan reda på molmassan av kalcium (40 g), syre (16 g) och väte (1 g).
- I formeln finns 2 atomer av syre och väte. Den totala massan av syre kommer att vara: 2 x 16 g = 32 g. Molmassan av väte kommer att vara: 2 x 1 g = 2 g.
- Tillsätt alla molmassor för att få 40 g + 32 g + 2 g = 74 g / mol.
 2 Dela molmassan med antalet väte- eller hydroxidmolekyler. Ta reda på antalet väteatomer (H) i en syra eller hydroxid (OH) molekyler i basen. Dela den totala molmassan som nyss erhållits med antalet atomer eller molekyler för att hitta vikten på 1 ekvivalent, vilket kommer att vara lika med massan av 1 mol väte eller hydroxid. I slutet av svaret skriver du förkortningen "G.-e." som betyder ekvivalentens massa.
2 Dela molmassan med antalet väte- eller hydroxidmolekyler. Ta reda på antalet väteatomer (H) i en syra eller hydroxid (OH) molekyler i basen. Dela den totala molmassan som nyss erhållits med antalet atomer eller molekyler för att hitta vikten på 1 ekvivalent, vilket kommer att vara lika med massan av 1 mol väte eller hydroxid. I slutet av svaret skriver du förkortningen "G.-e." som betyder ekvivalentens massa. - I vårt exempel är Ca (OH)2 2 två vätemolekyler, vilket innebär att ekvivalentmassan blir lika med 74 g / mol ÷ 2 = 37 G.-e.
 3 Dela lösningens faktiska vikt med motsvarande vikt. När du känner till ekvivalentens massa, dela den med massan av lösningen, som anges på behållaren med lösningen eller i problemet som ska lösas. Svaret blir antalet ekvivalenter i lösningen så att du sedan kan beräkna normaliteten. I slutet av svaret, sätt förkortningen "e."
3 Dela lösningens faktiska vikt med motsvarande vikt. När du känner till ekvivalentens massa, dela den med massan av lösningen, som anges på behållaren med lösningen eller i problemet som ska lösas. Svaret blir antalet ekvivalenter i lösningen så att du sedan kan beräkna normaliteten. I slutet av svaret, sätt förkortningen "e." - Om i vårt exempel 75 g Ca (OH)2, då kommer formeln att vara följande: 75 g ÷ 37 G.-e = 2,027 Oe.
 4 Dela antalet ekvivalenter med volymen lösning i liter. Ta reda på lösningens totala volym och skriv ner svaret i liter. Ta antalet ekvivalenter som just erhållits och dividera med volymen på lösningen för att ta reda på normaliteten. I slutet av ditt svar skriv en förkortning "N".
4 Dela antalet ekvivalenter med volymen lösning i liter. Ta reda på lösningens totala volym och skriv ner svaret i liter. Ta antalet ekvivalenter som just erhållits och dividera med volymen på lösningen för att ta reda på normaliteten. I slutet av ditt svar skriv en förkortning "N". - Om det finns 75 g Ca (OH) i en lösning med en volym på 8 liter2, dividera sedan antalet ekvivalenter med volymen på följande sätt: 2.027 Oe. ÷ 8 l = 0,253 N.
Tips
- Normal koncentration, eller normalitet, används vanligtvis för att mäta syror och baser. Om du behöver bestämma koncentrationen av en annan lösning görs detta vanligtvis genom att mäta molariteten.
Vad behöver du
- Periodiska systemet
- Kalkylator



