Författare:
Eugene Taylor
Skapelsedatum:
12 Augusti 2021
Uppdatera Datum:
22 Juni 2024
Innehåll
- Att gå
- Del 1 av 2: Den normala elektronkonfigurationen för ett element
- Del 2 av 2: Elektronkonfigurationen för ädelgas
- Varningar
Att skriva ut en elektronkonfiguration för ett element är ett bra sätt att titta på fördelningen av elektroner i en atom. Beroende på elementet kan formeln vara väldigt lång. Därför har forskare utvecklat en förkortningsnotation som använder ädelgas för att representera elektroner som inte är valenselektroner. Detta förenklar elektronkonfigurationen och gör det lättare att förstå elementets kemiska egenskaper.
Att gå
Del 1 av 2: Den normala elektronkonfigurationen för ett element
 Bestäm antalet elektroner som finns i elementet. Ett elements atomnummer berättar antalet protoner det har. Eftersom element i neutralt tillstånd har samma antal protoner och elektroner kan du också använda atomnumret som antalet elektroner som elementet har. Atomnumret, som du hittar i det periodiska systemet, är numret direkt ovanför elementets symbol.
Bestäm antalet elektroner som finns i elementet. Ett elements atomnummer berättar antalet protoner det har. Eftersom element i neutralt tillstånd har samma antal protoner och elektroner kan du också använda atomnumret som antalet elektroner som elementet har. Atomnumret, som du hittar i det periodiska systemet, är numret direkt ovanför elementets symbol. - Till exempel är symbolen för natrium Na. Atomtalet för Na är 11.
 Kunskap om elektronskal och energinivåer. Det första elektronskalet har bara s energinivå, det andra elektronskalet har både en s och en p energinivå. Det tredje elektronskalet har en energinivå s, p och d. Det fjärde elektronskalet har en energinivå s, p, d och f. Det finns mer än fyra elektronskal, men i gymnasiekemi kommer du vanligtvis bara att möta de fyra första.
Kunskap om elektronskal och energinivåer. Det första elektronskalet har bara s energinivå, det andra elektronskalet har både en s och en p energinivå. Det tredje elektronskalet har en energinivå s, p och d. Det fjärde elektronskalet har en energinivå s, p, d och f. Det finns mer än fyra elektronskal, men i gymnasiekemi kommer du vanligtvis bara att möta de fyra första. - Varje energinivå kan innehålla upp till 2 elektroner.
- Varje p-energinivå kan innehålla upp till 6 elektroner.
- Varje d-energinivå kan innehålla upp till 10 elektroner.
- Varje f-energinivå kan innehålla upp till 14 elektroner.
 Lär dig reglerna för elektronfyllning. Enligt Aufbau-principen måste du lägga till elektroner till de lägsta energinivåerna innan en elektron kan läggas till en högre energinivå. Varje energinivå kan ha flera suborbitaler, men varje suborbital kan rymma upp till två elektroner samtidigt. Energinivån s har en suborbital, p har 3 suborbitaler, d har 5 suborbitaler och f har 7 suborbitaler.
Lär dig reglerna för elektronfyllning. Enligt Aufbau-principen måste du lägga till elektroner till de lägsta energinivåerna innan en elektron kan läggas till en högre energinivå. Varje energinivå kan ha flera suborbitaler, men varje suborbital kan rymma upp till två elektroner samtidigt. Energinivån s har en suborbital, p har 3 suborbitaler, d har 5 suborbitaler och f har 7 suborbitaler. - D-energinivån har en något högre energi än det lägre elektronskalets energinivå, så det är mer sannolikt att den högre energinivån fylls än den lägre d-energinivån. För att skriva en elektronkonfiguration betyder det att det ser ut så här: 1s2s2p3s3p4s3d.
 Använd diagonalkonfigurationsdiagrammet för att skriva elektronkonfigurationer. Det enklaste sättet att komma ihåg hur elektroner fylls är att använda konfigurationsschemat. I detta skriver du ner varje skal och energinivåerna. Rita diagonala linjer uppifrån till höger till nedre vänster på varje rad. Konfigurationsschemat är som följer:
Använd diagonalkonfigurationsdiagrammet för att skriva elektronkonfigurationer. Det enklaste sättet att komma ihåg hur elektroner fylls är att använda konfigurationsschemat. I detta skriver du ner varje skal och energinivåerna. Rita diagonala linjer uppifrån till höger till nedre vänster på varje rad. Konfigurationsschemat är som följer: - 1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p - Till exempel: Elektronkonfigurationen för natrium (11 elektroner) är: 1s2s2p3s.
- 1s
 Bestäm den sista banan i varje konfiguration. Genom att titta på det periodiska systemet kan du bestämma vad den sista delskalan och den sista energinivån för elektronkonfigurationen kommer att vara. Bestäm först i vilket block elementet faller (s, p, d eller f). Räkna sedan vilken rad elementet är i. Slutligen räknar du vilken kolumn elementet är i.
Bestäm den sista banan i varje konfiguration. Genom att titta på det periodiska systemet kan du bestämma vad den sista delskalan och den sista energinivån för elektronkonfigurationen kommer att vara. Bestäm först i vilket block elementet faller (s, p, d eller f). Räkna sedan vilken rad elementet är i. Slutligen räknar du vilken kolumn elementet är i. - Till exempel är natrium i s-blocket, så den sista banan i dess elektronkonfiguration är s. Det är i tredje raden och den första kolumnen, så den sista banan är 3s. Detta är ett bra sätt att kontrollera ditt slutliga svar.
- Regeln är lite annorlunda för d orbital. Den första raden med d-blockelement börjar i den fjärde raden, men du måste subtrahera 1 från radnumret eftersom s-nivåerna har en lägre energi än d-nivåerna. Till exempel: vanadin slutar i 3d.
- Ett annat sätt att kontrollera ditt arbete är att lägga till alla överskrifter. De måste vara lika med antalet elektroner i elementet. Om du har för få eller för många elektroner bör du tänka om ditt arbete och försöka igen.
Del 2 av 2: Elektronkonfigurationen för ädelgas
 Bestäm konfigurationen av ädelgaselektron. Ädelgaselektronkonfigurationen är ett slags kortfattat sätt att skriva ut hela elektronkonfigurationen för ett element. Ädelgas-stenografin används för att sammanfatta elektronkonfigurationen för ett element samtidigt som den ger den mest relevanta informationen om valenselektronerna för det elementet.
Bestäm konfigurationen av ädelgaselektron. Ädelgaselektronkonfigurationen är ett slags kortfattat sätt att skriva ut hela elektronkonfigurationen för ett element. Ädelgas-stenografin används för att sammanfatta elektronkonfigurationen för ett element samtidigt som den ger den mest relevanta informationen om valenselektronerna för det elementet. - Ädelgasen ersätts för att representera alla elektroner som inte är valenselektroner.
- Ädelgaserna är helium, neon, argon, krypton, xenon och radon och befinner sig i den sista kolumnen i det periodiska systemet.
 Identifiera ädelgas under perioden för ditt element. Perioden för ett element är den horisontella raden i vilken elementet är beläget. Om elementet finns i den fjärde raden i det periodiska systemet, är det i period fyra. Ädelgasen du kommer att använda är i period tre. Nedan följer en lista över ädelgaser och deras perioder:
Identifiera ädelgas under perioden för ditt element. Perioden för ett element är den horisontella raden i vilken elementet är beläget. Om elementet finns i den fjärde raden i det periodiska systemet, är det i period fyra. Ädelgasen du kommer att använda är i period tre. Nedan följer en lista över ädelgaser och deras perioder: - 1: Helium
- 2: Neon
- 3: Argon
- 4: Krypton
- 5: Xenon
- 6: Radon
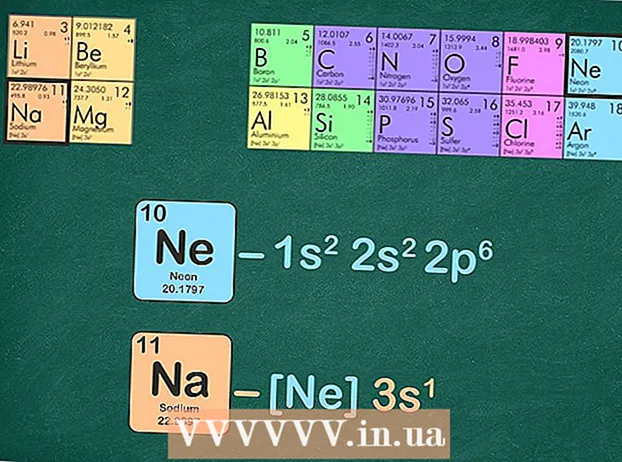
- Till exempel är natrium i period 3. Vi kommer att använda neon för ädelgaskonfigurationen eftersom det är i period 2.
 Ersätt ädelgasen med samma antal elektroner som ädelgasen har. Det finns några sätt att göra detta nästa steg. Du kan skriva ut ädelgasens elektronkonfiguration och sedan byta ut samma konfiguration i det intresse som du är intresserad av. Ett alternativ är att ta bort samma antal elektroner som ädelgasen har från det element som du skriver konfigurationen för.
Ersätt ädelgasen med samma antal elektroner som ädelgasen har. Det finns några sätt att göra detta nästa steg. Du kan skriva ut ädelgasens elektronkonfiguration och sedan byta ut samma konfiguration i det intresse som du är intresserad av. Ett alternativ är att ta bort samma antal elektroner som ädelgasen har från det element som du skriver konfigurationen för. - Till exempel har natrium 11 elektroner och neon har 10 elektroner.
- Den fullständiga elektronkonfigurationen för natrium är: 1s22p3s och neon är 1s22p. Som du kan se har natrium en 3s som neon inte gör - därför blir ädelgaskonfigurationen för natrium [Ne] 3s.
- Alternativt kan du räkna överskrivningarna av energinivåerna tills du har tio. Ta bort dessa energinivåer och än mindre vad som finns kvar. Om du använder neon för att skriva elektronkonfigurationen för natrium sitter du kvar med en elektron: [Ne] 3s.
Varningar
- Endast i en neutral atom är atomnumret lika med antalet elektroner. En jon innehåller ett annat antal elektroner. Om jonen har en laddning på -1 har den en extra elektron. En laddning -2 har två extra elektroner etc.



