Författare:
Mark Sanchez
Skapelsedatum:
3 Januari 2021
Uppdatera Datum:
1 Juli 2024
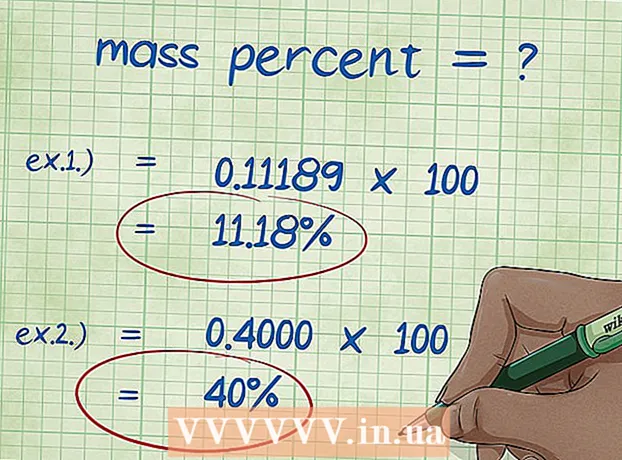
Innehåll
- Steg
- Metod 1 av 2: Bestämning av massprocent baserat på specificerade vikter
- Metod 2 av 2: Bestämning av massprocent när inga massor anges
Massprocent anger andelen element i en kemisk förening. För att hitta massprocenten måste du känna till molmassan (i gram per mol) av elementen som ingår i föreningen eller antalet gram för varje komponent som krävs för att få en given lösning.Massprocenten beräknas helt enkelt: det räcker med att dividera elementets (eller komponentens) massa med hela föreningens (eller lösningens) massa.
Steg
Metod 1 av 2: Bestämning av massprocent baserat på specificerade vikter
 1 Välj en ekvation för att bestämma viktprocenten av en kemisk förening. Massprocenten beräknas med följande formel: massprocent = (komponentmassa / total massa av förening) x 100. För att få procent multipliceras resultatet med division med 100.
1 Välj en ekvation för att bestämma viktprocenten av en kemisk förening. Massprocenten beräknas med följande formel: massprocent = (komponentmassa / total massa av förening) x 100. För att få procent multipliceras resultatet med division med 100. - I början av att lösa problemet, skriv ner jämställdheten: massprocent = (massa av komponent / total massa av förening) x 100.
- Massan av komponenten du är intresserad av bör vara i problemets skick. Om ingen massa anges, gå till nästa avsnitt, som förklarar hur man bestämmer massprocent med okänd massa.
- Den totala massan av en kemisk förening hittas genom att lägga till massorna av alla grundämnen (komponenter) som ingår i denna förening (eller lösning).
 2 Beräkna föreningens totala massa. Om du känner till massorna av alla komponenter som utgör föreningen, lägg bara till dem, och på så sätt hittar du den totala massan av den resulterande föreningen eller lösningen. Du använder denna massa som nämnare i din ekvation för massprocent.
2 Beräkna föreningens totala massa. Om du känner till massorna av alla komponenter som utgör föreningen, lägg bara till dem, och på så sätt hittar du den totala massan av den resulterande föreningen eller lösningen. Du använder denna massa som nämnare i din ekvation för massprocent. - Exempel 1: Vad är massprocenten av 5 gram natriumhydroxid upplöst i 100 gram vatten?
- Lösningens totala massa är lika med summan av mängden natriumhydroxid och vatten: 100 g + 5 g ger 105 g.
- Exempel 2: Hur mycket natriumklorid och vatten behöver du för att göra 175 gram av en 15 procents lösning?
- I detta exempel anges den totala massan och den erforderliga procentsatsen, och det är nödvändigt att hitta mängden ämne som behöver tillsättas till lösningen. Totalvikten är 175 gram.
- Exempel 1: Vad är massprocenten av 5 gram natriumhydroxid upplöst i 100 gram vatten?
 3 Bestäm massan för den angivna komponenten. Om du blir ombedd att beräkna "massprocent" bör du ta reda på hur många procent av den totala massan av ett ämne som är massan av en viss komponent. Anteckna massan för den angivna komponenten. Detta blir täljaren i formeln för massprocenten.
3 Bestäm massan för den angivna komponenten. Om du blir ombedd att beräkna "massprocent" bör du ta reda på hur många procent av den totala massan av ett ämne som är massan av en viss komponent. Anteckna massan för den angivna komponenten. Detta blir täljaren i formeln för massprocenten. - Exempel 1: Massan av en given komponent - natriumhydroklorid - är 5 gram.
- Exempel 2: I detta exempel är massan av den givna komponenten okänd och måste hittas.
 4 Anslut värdena till massprocentekvationen. När du har bestämt alla nödvändiga värden ansluter du dem till formeln.
4 Anslut värdena till massprocentekvationen. När du har bestämt alla nödvändiga värden ansluter du dem till formeln. - Exempel 1: massprocent = (komponentmassa / total massa av förening) x 100 = (5 g / 105 g) x 100.
- Exempel 2: det är nödvändigt att transformera formeln för massprocenten så att den okända massan av den kemiska komponenten kan hittas: komponentens massa = (massprocent * total massa av föreningen) / 100 = (15 * 175) / 100.
 5 Beräkna massprocenten. Efter att alla värden i formeln har ersatts med massprocenten, utför de nödvändiga beräkningarna. Dela massan av en komponent med den totala vikten av den kemiska föreningen eller lösningen och multiplicera med 100. Resultatet är massprocenten av den komponenten.
5 Beräkna massprocenten. Efter att alla värden i formeln har ersatts med massprocenten, utför de nödvändiga beräkningarna. Dela massan av en komponent med den totala vikten av den kemiska föreningen eller lösningen och multiplicera med 100. Resultatet är massprocenten av den komponenten. - Exempel 1: (5/105) x 100 = 0,04761 x 100 = 4,761%. Således är viktprocenten av 5 gram natriumhydroklorid upplöst i 100 gram vatten 4.761%.
- Exempel 2: Det omskrivna uttrycket för en komponents massprocent är (massprocent * ämnets totala massa) / 100, varifrån vi hittar: (15 * 175) / 100 = (2625) / 100 = 26,25 gram natriumklorid.
- Vi hittar den nödvändiga mängden vatten genom att subtrahera komponentens massa från lösningens totala massa: 175 - 26,25 = 148,75 gram vatten.
Metod 2 av 2: Bestämning av massprocent när inga massor anges
 1 Välj en formel för viktprocenten av en kemisk förening. Den grundläggande ekvationen för att hitta massprocent är följande: massprocent = (molmassa av ett element / total molekylmassa för en förening) x 100. Molnmassa för ett ämne är massan av en mol av ett givet ämne, medan molekylmassa är massan av en mol av hela kemikalieförbindelserna. Divisionen multipliceras med 100 för att få procentsatserna.
1 Välj en formel för viktprocenten av en kemisk förening. Den grundläggande ekvationen för att hitta massprocent är följande: massprocent = (molmassa av ett element / total molekylmassa för en förening) x 100. Molnmassa för ett ämne är massan av en mol av ett givet ämne, medan molekylmassa är massan av en mol av hela kemikalieförbindelserna. Divisionen multipliceras med 100 för att få procentsatserna. - I början av att lösa problemet, skriv ner jämställdheten: massprocent = (molmassa av grundämne / total molekylmassa av förening) x 100.
- Båda mängderna mäts i gram per mol (g / mol).
- Om du inte får massor kan massprocenten av ett element i ett givet ämne hittas med hjälp av molmassa.
- Exempel 1: Hitta massprocent väte i en vattenmolekyl.
- Exempel 2: Hitta massprocenten kol i en glukosmolekyl.
 2 Skriv ner den kemiska formeln. Om exemplet inte ger de kemiska formlerna för de angivna ämnena, bör du skriva ner dem själv. Om uppgiften innehåller de nödvändiga formlerna för kemiska ämnen kan du hoppa över detta steg och gå direkt till nästa steg (hitta massan för varje element).
2 Skriv ner den kemiska formeln. Om exemplet inte ger de kemiska formlerna för de angivna ämnena, bör du skriva ner dem själv. Om uppgiften innehåller de nödvändiga formlerna för kemiska ämnen kan du hoppa över detta steg och gå direkt till nästa steg (hitta massan för varje element). - Exempel 1: Skriv ner den kemiska formeln för vatten, H2O.
- Exempel 2: Skriv ner den kemiska formeln för glukos, C6H12O6.
 3 Hitta massan av varje element i föreningen. Bestäm molvikten för varje grundämne i den kemiska formeln enligt det periodiska systemet. Typiskt anges massan av ett element med dess kemiska symbol. Skriv ner molmassorna för alla element som utgör föreningen i fråga.
3 Hitta massan av varje element i föreningen. Bestäm molvikten för varje grundämne i den kemiska formeln enligt det periodiska systemet. Typiskt anges massan av ett element med dess kemiska symbol. Skriv ner molmassorna för alla element som utgör föreningen i fråga. - Exempel 1: Hitta molmassorna av syre (15.9994) och väte (1.0079).
- Exempel 2: Hitta molmassorna av kol (12.0107), syre (15.9994) och väte (1.0079).
 4 Multiplicera molmassan för varje element med dess molfraktion. Bestäm hur många mol av varje element som finns i en given kemikalie, det vill säga molfraktionerna av elementen. Molfraktioner ges av siffrorna längst ner på elementets symboler i formeln. Multiplicera molmassan för varje element med dess molfraktion.
4 Multiplicera molmassan för varje element med dess molfraktion. Bestäm hur många mol av varje element som finns i en given kemikalie, det vill säga molfraktionerna av elementen. Molfraktioner ges av siffrorna längst ner på elementets symboler i formeln. Multiplicera molmassan för varje element med dess molfraktion. - Exempel 1: det finns 2 under vätesymbolen och 1 under syresymbolen (motsvarar frånvaron av ett tal). Sålunda bör molmassan av väte multipliceras med 2: 1,00794 X 2 = 2,01588; vi lämnar molmassan av syre densamma, 15.9994 (det vill säga multiplicera med 1).
- Exempel 2: under symbolen för kol finns det 6, under väte 12 och under syre 6. Multiplicera molekylmassorna av elementen med dessa siffror:
- kol: (12,0107 * 6) = 72,0642
- väte: (1,00794 * 12) = 12,09528
- syre: (15.9994 * 6) = 95.9964
 5 Beräkna föreningens totala massa. Lägg ihop de hittade massorna av alla element som ingår i denna förening. Summan av molmassorna av elementen multiplicerad med molfraktionerna ger dig den totala massan av den kemiska föreningen. Detta tal är divisorn i formeln för massprocent.
5 Beräkna föreningens totala massa. Lägg ihop de hittade massorna av alla element som ingår i denna förening. Summan av molmassorna av elementen multiplicerad med molfraktionerna ger dig den totala massan av den kemiska föreningen. Detta tal är divisorn i formeln för massprocent. - Exempel 1: Lägg till 2,01588 g / mol (massan av två mol väteatomer) 15,9999 g / mol (massan av en mol syreatomer), resultatet är 18,01528 g / mol.
- Exempel 2: Lägg till de hittade molmassorna: kol + väte + syre = 72,0642 + 12,09528 + 95,9964 = 180,156 g / mol.
 6 Bestäm massan av elementet av intresse. Om du blir ombedd att hitta "massprocenten", bör du beräkna massan av ett visst element som är en del av föreningen, i procent av den totala massan av alla element. Hitta massan av ett givet element och skriv ner det. För att göra detta är det nödvändigt att multiplicera elementets molmassa med dess molfraktion. Som ett resultat får du värdet i formelens räknare för massprocenten.
6 Bestäm massan av elementet av intresse. Om du blir ombedd att hitta "massprocenten", bör du beräkna massan av ett visst element som är en del av föreningen, i procent av den totala massan av alla element. Hitta massan av ett givet element och skriv ner det. För att göra detta är det nödvändigt att multiplicera elementets molmassa med dess molfraktion. Som ett resultat får du värdet i formelens räknare för massprocenten. - Exempel 1: Massan av väte i föreningen är 2,01588 g / mol (massan av två mol väteatomer).
- Exempel 2: Kolmassan i föreningen är 72,0642 g / mol (massan av sex mol kolatomer).
 7 Ersätt numeriska värden i massprocentekvationen. När du har bestämt värdena för alla kvantiteter kopplar du in dem i formeln som gavs i det första steget: massprocent = (molmassa av elementet / föreningens totala molekylmassa) x 100.
7 Ersätt numeriska värden i massprocentekvationen. När du har bestämt värdena för alla kvantiteter kopplar du in dem i formeln som gavs i det första steget: massprocent = (molmassa av elementet / föreningens totala molekylmassa) x 100. - Exempel 1: massprocent = (molmassa av element / total molekylmassa av förening) x 100 = (2.01588 / 18.01528) x 100.
- Exempel 2: massprocent = (molmassa av element / total molekylmassa av förening) x 100 = (72,0642 / 180,156) x 100.
 8 Beräkna massprocenten. Efter att du har ersatt numeriska värden, utför de erforderliga aritmetiska operationerna.Dela elementets massa med föreningens totala massa och multiplicera med 100. Resultatet är elementets massprocent.
8 Beräkna massprocenten. Efter att du har ersatt numeriska värden, utför de erforderliga aritmetiska operationerna.Dela elementets massa med föreningens totala massa och multiplicera med 100. Resultatet är elementets massprocent. - Exempel 1: massprocent = (molmassa av element / total molekylmassa av förening) x 100 = (2.01588 / 18.01528) x 100 = 0.111189 x 100 = 11.18%. Således är massprocenten av väteatomer i en vattenmolekyl 11,18%.
- Exempel 2: massprocent = (molmassa av grundämne / total molekylmassa av förening) x 100 = (72,0642 / 180,156) x 100 = 0,4000 x 100 = 40,00%. Således är viktprocenten av kolatomer i glukosmolekylen 40,00%.



