Innehåll
- Steg
- Metod 1 av 3: Hitta atommassa med hjälp av elementernas periodiska system
- Metod 2 av 3: Beräkning av en atoms atommassa
- Metod 3 av 3: Beräkning av den relativa atommassan (atomvikt) för ett element
- Tips
- Vad behöver du
Atomisk massa är summan av massorna av alla protoner, neutroner och elektroner som utgör denna eller den där atomen eller molekylen. Jämfört med protoner och neutroner är elektronmassan mycket liten, så den tas inte med i beräkningarna. Även om detta är felaktigt ur en formell synvinkel, används detta begrepp ofta för att hänvisa till den genomsnittliga atommassan för alla isotoper av ett element. I själva verket är detta den relativa atommassan, även kallad atomvikt element. Atomvikt är medelvärdet av atommassorna för alla naturligt förekommande isotoper av ett element. Kemister måste skilja mellan dessa två typer av atommassa när de gör sitt jobb - ett felaktigt atommassavärde kan till exempel leda till ett felaktigt resultat för utbytet av en reaktionsprodukt.
Steg
Metod 1 av 3: Hitta atommassa med hjälp av elementernas periodiska system
 1 Lär dig hur atommassa skrivs. Atommassa, det vill säga massan av en given atom eller molekyl, kan uttryckas i standard SI -enheter - gram, kilogram och så vidare. Men på grund av det faktum att atommassorna som uttrycks i dessa enheter är extremt små, registreras de ofta i enhetliga atommassanheter eller förkortade amu. - atommassa enheter. En atommassa är lika med 1/12 av massan av standardisotopen kol-12.
1 Lär dig hur atommassa skrivs. Atommassa, det vill säga massan av en given atom eller molekyl, kan uttryckas i standard SI -enheter - gram, kilogram och så vidare. Men på grund av det faktum att atommassorna som uttrycks i dessa enheter är extremt små, registreras de ofta i enhetliga atommassanheter eller förkortade amu. - atommassa enheter. En atommassa är lika med 1/12 av massan av standardisotopen kol-12. - Atomenhetens massa kännetecknar massan en mol av ett givet element i gram... Detta värde är mycket användbart i praktiska beräkningar, eftersom det kan användas för att enkelt omvandla massan av ett visst antal atomer eller molekyler av ett givet ämne till mol, och vice versa.
 2 Hitta atommassan i det periodiska systemet. De flesta vanliga periodiska tabellerna innehåller atommassorna (atomvikterna) för varje element. Som regel visas de som ett tal längst ner i cellen med elementet, under bokstäverna som anger det kemiska elementet. Detta är vanligtvis inte ett heltal, utan en decimal bråkdel.
2 Hitta atommassan i det periodiska systemet. De flesta vanliga periodiska tabellerna innehåller atommassorna (atomvikterna) för varje element. Som regel visas de som ett tal längst ner i cellen med elementet, under bokstäverna som anger det kemiska elementet. Detta är vanligtvis inte ett heltal, utan en decimal bråkdel. - Observera att alla relativa atommassor som anges i det periodiska systemet för varje element är genomsnitt värden. De kemiska elementen har olika isotoper - kemiska arter som har olika massor på grund av ytterligare eller saknade neutroner i atomkärnan. Därför kan de relativa atommassorna som anges i det periodiska systemet användas som ett genomsnitt för atomerna i ett visst element, men inte som massan av en atom av ett givet element.
- De relativa atommassorna som anges i det periodiska systemet används för att beräkna molmassorna för atomer och molekyler. Atommassor uttryckta i amu (som i det periodiska systemet) är väsentligen dimensionslösa. Men helt enkelt genom att multiplicera atommassan med 1 g / mol får vi en användbar egenskap hos ett element - massan (i gram) av en mol atomer av detta element.
 3 Kom ihåg att det periodiska systemet listar de genomsnittliga atommassorna för elementen. Som nämnts tidigare är de relativa atommassorna som anges för varje element i det periodiska systemet genomsnittet av massorna för alla isotoper i en atom. Detta genomsnitt är värdefullt för många praktiska ändamål: det används till exempel för att beräkna molmassan av molekyler som består av flera atomer. Men när du har att göra med enskilda atomer är detta värde vanligtvis inte tillräckligt.
3 Kom ihåg att det periodiska systemet listar de genomsnittliga atommassorna för elementen. Som nämnts tidigare är de relativa atommassorna som anges för varje element i det periodiska systemet genomsnittet av massorna för alla isotoper i en atom. Detta genomsnitt är värdefullt för många praktiska ändamål: det används till exempel för att beräkna molmassan av molekyler som består av flera atomer. Men när du har att göra med enskilda atomer är detta värde vanligtvis inte tillräckligt. - Eftersom den genomsnittliga atommassan är medelvärdet för flera isotoper är värdet som anges i det periodiska systemet inte exakt värdet av atommassan för en enskild atom.
- Atommassorna för enskilda atomer måste beräknas med hänsyn till det exakta antalet protoner och neutroner i en enda atom.
Metod 2 av 3: Beräkning av en atoms atommassa
 1 Hitta atomnumret för ett givet element eller dess isotop. Atomnumret är antalet protoner i atomernas atomer, det ändras aldrig. Till exempel alla väteatomer och endast de har en proton. Atomnumret för natrium är 11, eftersom dess kärna har elva protoner, medan atomens antal syre är åtta, eftersom dess kärna har åtta protoner. Du kan hitta atomnumret för alla element i Mendelejovs periodiska system - i nästan alla dess standardversioner är detta nummer angivet ovanför bokstavsbeteckningen för det kemiska elementet. Atomnumret är alltid ett positivt heltal.
1 Hitta atomnumret för ett givet element eller dess isotop. Atomnumret är antalet protoner i atomernas atomer, det ändras aldrig. Till exempel alla väteatomer och endast de har en proton. Atomnumret för natrium är 11, eftersom dess kärna har elva protoner, medan atomens antal syre är åtta, eftersom dess kärna har åtta protoner. Du kan hitta atomnumret för alla element i Mendelejovs periodiska system - i nästan alla dess standardversioner är detta nummer angivet ovanför bokstavsbeteckningen för det kemiska elementet. Atomnumret är alltid ett positivt heltal. - Antag att vi är intresserade av en kolatom. Det finns alltid sex protoner i kolatomer, så vi vet att dess atomnummer är 6. Dessutom ser vi att i det periodiska systemet, i den övre delen av cellen med kol (C) är siffran "6", vilket indikerar att atomkolnumret är sex.
- Observera att atomnumret för ett element inte är unikt relaterat till dess relativa atommassa i det periodiska systemet. Även om det särskilt för elementen högst upp i tabellen kan se ut som att atommassan för ett element är dubbelt dess atomnummer beräknas det aldrig genom att multiplicera atomnumret med två.
 2 Hitta antalet neutroner i kärnan. Antalet neutroner kan vara olika för olika atomer av samma element. När två atomer av samma element med samma antal protoner har ett annat antal neutroner, är de olika isotoper av det elementet.Till skillnad från antalet protoner, som aldrig förändras, kan antalet neutroner i atomerna i ett visst element ofta förändras, så den genomsnittliga atommassan för ett element skrivs som en decimalfraktion med ett värde som ligger mellan två intilliggande heltal.
2 Hitta antalet neutroner i kärnan. Antalet neutroner kan vara olika för olika atomer av samma element. När två atomer av samma element med samma antal protoner har ett annat antal neutroner, är de olika isotoper av det elementet.Till skillnad från antalet protoner, som aldrig förändras, kan antalet neutroner i atomerna i ett visst element ofta förändras, så den genomsnittliga atommassan för ett element skrivs som en decimalfraktion med ett värde som ligger mellan två intilliggande heltal. - Antalet neutroner kan bestämmas genom beteckningen av elementets isotop. Till exempel är kol-14 en naturligt förekommande radioaktiv isotop av kol-12. Ofta indikeras isotopnumret som ett överskriftstal framför elementets symbol: C. Antalet neutroner hittas genom att subtrahera antalet protoner från isotopnumret: 14 - 6 = 8 neutroner.
- Låt oss säga att kolatomen av intresse har sex neutroner (C). Det är den vanligaste isotopen av kol och står för cirka 99% av alla atomer i detta element. Omkring 1% av kolatomerna har dock 7 neutroner (C). Andra typer av kolatomer har mer än 7 eller mindre än 6 neutroner och finns i mycket små mängder.
 3 Lägg till antalet protoner och neutroner. Detta kommer att vara atommassan för den givna atomen. Ignorera antalet elektroner som omger kärnan - deras totala massa är extremt liten, så de påverkar praktiskt taget inte dina beräkningar.
3 Lägg till antalet protoner och neutroner. Detta kommer att vara atommassan för den givna atomen. Ignorera antalet elektroner som omger kärnan - deras totala massa är extremt liten, så de påverkar praktiskt taget inte dina beräkningar. - Vår kolatom har 6 protoner + 6 neutroner = 12. Därmed är atommassan för denna kolatom 12. Om detta var isotopen "kol-13", då skulle vi veta att den har 6 protoner + 7 neutroner = atomvikt 13.
- Faktum är att atommassan för kol-13 är 13.003355, och detta värde är mer exakt, eftersom det bestämdes experimentellt.
- Atommassan ligger mycket nära isotopnumret. För att göra beräkningarna enklare antas isotopantalet ofta vara lika med atommassan. De experimentellt bestämda värdena för atommassan överskrider något isotoptalet på grund av elektronernas mycket lilla bidrag.
Metod 3 av 3: Beräkning av den relativa atommassan (atomvikt) för ett element
 1 Bestäm vilka isotoper som finns i provet. Kemister bestämmer ofta förhållandet mellan isotoper i ett visst prov med hjälp av ett speciellt instrument som kallas en masspektrometer. Under utbildningen kommer dock dessa data att tillhandahållas till dig i förhållande till uppgifter, kontroll och så vidare i form av värden från vetenskaplig litteratur.
1 Bestäm vilka isotoper som finns i provet. Kemister bestämmer ofta förhållandet mellan isotoper i ett visst prov med hjälp av ett speciellt instrument som kallas en masspektrometer. Under utbildningen kommer dock dessa data att tillhandahållas till dig i förhållande till uppgifter, kontroll och så vidare i form av värden från vetenskaplig litteratur. - I vårt fall, låt oss säga att vi har att göra med två isotoper: kol-12 och kol-13.
 2 Bestäm det relativa innehållet för varje isotop i provet. För varje element förekommer olika isotoper i olika proportioner. Dessa förhållanden uttrycks nästan alltid som procentsatser. Vissa isotoper är mycket vanliga, medan andra är mycket sällsynta - ibland så svåra att upptäcka. Dessa mängder kan bestämmas med masspektrometri eller finns i en handbok.
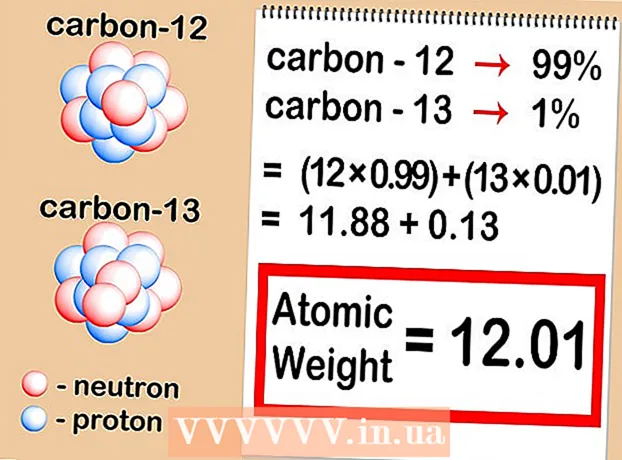
2 Bestäm det relativa innehållet för varje isotop i provet. För varje element förekommer olika isotoper i olika proportioner. Dessa förhållanden uttrycks nästan alltid som procentsatser. Vissa isotoper är mycket vanliga, medan andra är mycket sällsynta - ibland så svåra att upptäcka. Dessa mängder kan bestämmas med masspektrometri eller finns i en handbok. - Låt oss säga att koncentrationen av kol-12 är 99%och kol-13 är 1%. Andra isotoper av kol verkligen finns, men i så små mängder att de i detta fall kan försummas.
 3 Multiplicera atommassan för varje isotop med dess koncentration i provet. Multiplicera atommassan för varje isotop med dess procentandel (uttryckt som en decimalfraktion). För att konvertera procentsatser till decimaler, dividera helt enkelt med 100. De resulterande koncentrationerna bör alltid lägga upp till 1.
3 Multiplicera atommassan för varje isotop med dess koncentration i provet. Multiplicera atommassan för varje isotop med dess procentandel (uttryckt som en decimalfraktion). För att konvertera procentsatser till decimaler, dividera helt enkelt med 100. De resulterande koncentrationerna bör alltid lägga upp till 1. - Vårt prov innehåller kol-12 och kol-13. Om kol-12 är 99% av provet och kol-13 är 1%, är det nödvändigt att multiplicera 12 (atommassa av kol-12) med 0,99 och 13 (atommassa av kol-13) med 0,01.
- Referensböckerna ger procentandelar baserat på de kända mängderna av alla isotoper av ett element. De flesta kemibokböcker innehåller denna information i tabellform i slutet av boken. För det prov som undersöks kan de relativa koncentrationerna av isotoper också bestämmas med hjälp av en masspektrometer.
 4 Lägg till resultaten. Sammanfatta multiplikationsresultaten du fick i föregående steg.Som ett resultat av denna operation hittar du den relativa atommassan för ditt element - medelvärdet av atommassorna för isotoperna för elementet i fråga. När man betraktar ett element som helhet, snarare än en specifik isotop för ett givet element, är det detta värde som används.
4 Lägg till resultaten. Sammanfatta multiplikationsresultaten du fick i föregående steg.Som ett resultat av denna operation hittar du den relativa atommassan för ditt element - medelvärdet av atommassorna för isotoperna för elementet i fråga. När man betraktar ett element som helhet, snarare än en specifik isotop för ett givet element, är det detta värde som används. - I vårt exempel är 12 x 0,99 = 11,88 för kol-12 och 13 x 0,01 = 0,13 för kol-13. Den relativa atommassan i vårt fall är 11,88 + 0,13 = 12,01.
Tips
- Vissa isotoper är mindre stabila än andra: de sönderfaller till atomer av element med färre protoner och neutroner i kärnan och frigör partiklar som utgör atomkärnan. Sådana isotoper kallas radioaktiva.
Vad behöver du
- Handbok för kemi
- Kalkylator