Innehåll
- Att gå
- Metod 1 av 3: Kom igång
- Metod 2 av 3: Hur bestämmer du massprocenten för givna massor
- Metod 3 av 3: Hur bestämmer du massprocenten om massorna inte anges
- Tips
Du kommer att bli ombedd att bestämma "massprocenten" för en viss kemikalie för ett kemitest. Läs först innan du får panik. Det är mycket lättare än det låter.
Att gå
Metod 1 av 3: Kom igång
En massprocent är massan av en viss kemikalie dividerad med den totala massan av alla kemikalier i en lösning / förening, uttryckt i procent. Det finns två sätt att närma sig denna massprocentfråga. Läs vidare nedan för att avgöra vilken metod du ska ta.
- Bestäm om frågan du behöver lösa ger dig massorna med kemikalier eller inte.
- När massorna ges. Om massan av de kemiska ämnena redan anges i frågan, som med "Hur stor är massprocenten av 5 g natriumhydroxid löst i 100 g vatten?"följ sedan instruktionerna som beskrivs nedan i avsnittet "Hur man bestämmer massprocenten för givna massor".
- Om massorna inte ges. Ibland blir du ombedd att ange massprocenten, men kemikaliernas massa är okänd. I dessa fall använder du de kemiska formlerna för att lösa upp de kemiska massorna. En sådan fråga kan se ut så här, "Bestäm massprocenten väte i en vattenmolekyl?" Om så är fallet, följ instruktionerna i avsnittet "Hur man bestämmer massprocenten, om massorna inte ges".
Metod 2 av 3: Hur bestämmer du massprocenten för givna massor
Nedan hittar du de steg som krävs för att lösa en fråga om massprocenten där massan av de kemiska ämnena anges. En sådan fråga kan se ut så här, "Vad är massprocenten av 5 g natriumhydroxid upplöst i 100 g vatten?" Exemplen i detta avsnitt utarbetar denna fråga.
 Beräkna den totala massan. Lägg samman alla massor av alla element i föreningen eller lösningen. Detta ger dig den totala massan. Detta är nämnaren. Skriv ner dessa.
Beräkna den totala massan. Lägg samman alla massor av alla element i föreningen eller lösningen. Detta ger dig den totala massan. Detta är nämnaren. Skriv ner dessa. - Till exempel, i detta steg skulle du göra 100 g + 5 g för den totala massan av 105 g.
 Bestäm vad den begärda kemikalien är. När du blir ombedd att hitta "massprocent", blir du ombedd att bestämma massan för en viss kemikalie (kemikalien som begärs), som en procentandel av den totala massan av alla element. Bestäm vad din kemikalie i fråga är. Skriv ner dessa. Det här är din räknare.
Bestäm vad den begärda kemikalien är. När du blir ombedd att hitta "massprocent", blir du ombedd att bestämma massan för en viss kemikalie (kemikalien som begärs), som en procentandel av den totala massan av alla element. Bestäm vad din kemikalie i fråga är. Skriv ner dessa. Det här är din räknare. - I detta steg bestämmer du till exempel att den begärda kemikalien är 5 g natriumhydroxid.
 Dela med sig. Dela massan av den begärda kemikalien, som finns i steget "Bestäm den begärda kemikalien", med den totala massan som beräknas i "Beräkna den totala massan". Resultatet av denna uppdelning är massan.
Dela med sig. Dela massan av den begärda kemikalien, som finns i steget "Bestäm den begärda kemikalien", med den totala massan som beräknas i "Beräkna den totala massan". Resultatet av denna uppdelning är massan. - I detta steg delar du till exempel 5 g (massa natriumhydroxid) med 105 (total massa) för att få massförhållandet 0,04761.
 Beräkna procentsatsen. Multiplicera massförhållandet som hittats med 100. Detta ger massprocenten.
Beräkna procentsatsen. Multiplicera massförhållandet som hittats med 100. Detta ger massprocenten. - Till exempel, i det här steget multiplicerar du 0,04761 med 100 för att få 4,761%. Således är massprocenten 5 gram natriumhydroxid löst i 100 gram vatten 4,761%.
Metod 3 av 3: Hur bestämmer du massprocenten om massorna inte anges
Nedan hittar du de steg som krävs för att lösa en fråga om massprocentandelar där de kemiska massorna inte anges. En sådan fråga kan se ut så här, "Bestäm massprocenten väte i en vattenmolekyl?Exemplen i detta avsnitt utarbetar detta problem.
 Läs följande definitioner. Innan du kan beräkna massprocenten i ett sådant uttalande måste du förstå de kemiska begreppen nedan.
Läs följande definitioner. Innan du kan beräkna massprocenten i ett sådant uttalande måste du förstå de kemiska begreppen nedan. - Komposittyger. En förening bildas genom att kombinera två eller flera olika kemiska element. Dessa element hålls samman av kovalenta bindningar eller jonbindningar. Elementen i kompositmaterial kan separeras igen genom kemisk reaktion.
- Till exempel. Väte och syre är olika kemiska element. En vattenmolekyl är därför en sammansatt substans eftersom den består av två väteatomer och en syreatom.
- Kemiska formler. En förenad substans kan listas i förkortad form. Detta kallas en kemisk formel. En kemisk formel tar också hänsyn till den relativa mängden av varje atom i en förening.
- Till exempel. Den kemiska formeln för vatten består av ett "H" för väte och ett "O" för syre. Eftersom det finns två väteatomer på varje syreatom i en vattenmolekyl, bör den kemiska formeln för vatten bestå av två H per O. Således är den kemiska formeln för vatten skriven som H2O.
- Molförhållandet. Den relativa mängden av en atomtyp jämfört med den för en annan atomtyp i en förening kallas antalet mol. Du kan hitta detta genom att titta på den kemiska formeln för en förening.
- Till exempel. Den kemiska formeln för vatten är H2O. Genom att sönderdela denna formel vet vi att molförhållandet väte och syre i en vattenmolekyl är lika med 2: 1.
- Komposittyger. En förening bildas genom att kombinera två eller flera olika kemiska element. Dessa element hålls samman av kovalenta bindningar eller jonbindningar. Elementen i kompositmaterial kan separeras igen genom kemisk reaktion.
 Skriv ut den kemiska formeln. Kanske har de kemiska formlerna givits, men om så inte är fallet, skriv först ner de kemiska formlerna för varje önskad förening. Om kemiska formler ges kan du hoppa över detta steg och fortsätta med steget "Bestäm massan för varje element".
Skriv ut den kemiska formeln. Kanske har de kemiska formlerna givits, men om så inte är fallet, skriv först ner de kemiska formlerna för varje önskad förening. Om kemiska formler ges kan du hoppa över detta steg och fortsätta med steget "Bestäm massan för varje element". - I detta steg måste du till exempel skriva den kemiska formeln för vatten som H2O.
 Bestämmer massan för varje element. Slå upp molekylvikten för varje element i den kemiska formeln i det periodiska systemet. Skriv ner dessa.
Bestämmer massan för varje element. Slå upp molekylvikten för varje element i den kemiska formeln i det periodiska systemet. Skriv ner dessa. - Till exempel, i detta steg letar du efter syrgasmolekylvikten, 15,9994; och molekylvikten av väte, 1,00794.
 Multiplicera massorna med molförhållandet. Bestäm hur många mol som finns i varje element i föreningen. Multiplicera molmassan med molförhållandet. Skriv ner dessa.
Multiplicera massorna med molförhållandet. Bestäm hur många mol som finns i varje element i föreningen. Multiplicera molmassan med molförhållandet. Skriv ner dessa. - I detta steg är till exempel molförhållandet väte och syre i vatten 2: 1.Därför multiplicerar du molmassan av väte med 2.100794 X 2 = 2.01588; och lämna den molära mängden syre som den är, 15.9994.
 Beräkna den totala massan. Lägg till den totala massan av alla element i din sammansättning. Se till att använda massorna från steget "Multiplicera massorna med molförhållandet" för att ta hänsyn till de rätta molförhållandena. Skriv ner dessa. Det här är din nämnare.
Beräkna den totala massan. Lägg till den totala massan av alla element i din sammansättning. Se till att använda massorna från steget "Multiplicera massorna med molförhållandet" för att ta hänsyn till de rätta molförhållandena. Skriv ner dessa. Det här är din nämnare. - Till exempel, i detta steg lägger du till 2.01588 (massan av 2 mol väteatomer) före 15.9994 (massan av 1 mol syreatomer) och du får 18.01528.
 Bestäm den begärda kemikalien. När du blir ombedd att beräkna "procentandel av massa", blir du ombedd att bestämma massan för en viss kemikalie (den begärda kemikalien) som en procentandel av den totala massan av alla element. Bestäm den begärda kemikalien. Skriv ner dessa. Detta är nämnaren.
Bestäm den begärda kemikalien. När du blir ombedd att beräkna "procentandel av massa", blir du ombedd att bestämma massan för en viss kemikalie (den begärda kemikalien) som en procentandel av den totala massan av alla element. Bestäm den begärda kemikalien. Skriv ner dessa. Detta är nämnaren. - Till exempel, i detta steg upptäcker du att den begärda kemikalien är väte.
 Dela med sig. Dela massan för den begärda kemikalien från steget "Bestäm den begärda kemikalien" med den totala massan beräknad i "Beräkna den totala massan". Detta beräknade antal är massförhållandet.
Dela med sig. Dela massan för den begärda kemikalien från steget "Bestäm den begärda kemikalien" med den totala massan beräknad i "Beräkna den totala massan". Detta beräknade antal är massförhållandet. - I detta steg delar du till exempel 2.01588 (massan av väteatomer) med 18.01528 (totalmassan för en vattenmolekyl). Detta ger dig ett massförhållande på 0,111189.
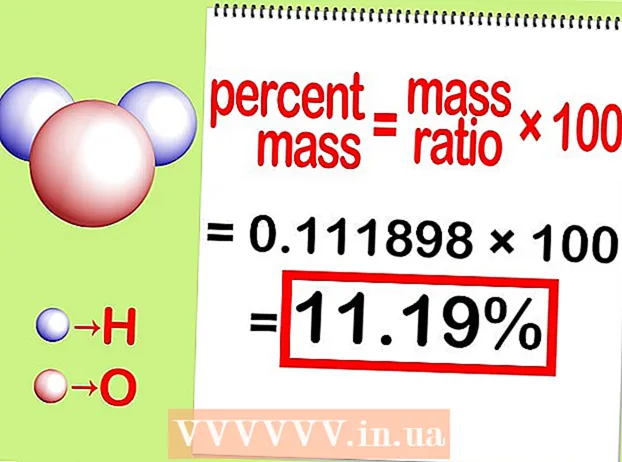
 Beräkna procentsatsen. Multiplicera det resulterande massförhållandet från "Dela" steget med 100. Detta ger dig svaret, massprocenten.
Beräkna procentsatsen. Multiplicera det resulterande massförhållandet från "Dela" steget med 100. Detta ger dig svaret, massprocenten. - I detta steg multiplicerar du till exempel 0.11189 med 100 för att få 11,18%. Massprocenten väteatomer i en vattenmolekyl är 11,18%.
Tips
- Se till att din kemiska formel är balanserad i steget "Skriv den kemiska formeln". Om den kemiska formeln ges bör den vara i balans. Men om du först ombads att lösa en kemisk ekvation för att skapa den ovannämnda kemiska formeln, se till att den är balanserad innan massprocenten bestäms.



