Författare:
Sara Rhodes
Skapelsedatum:
12 Februari 2021
Uppdatera Datum:
1 Juli 2024
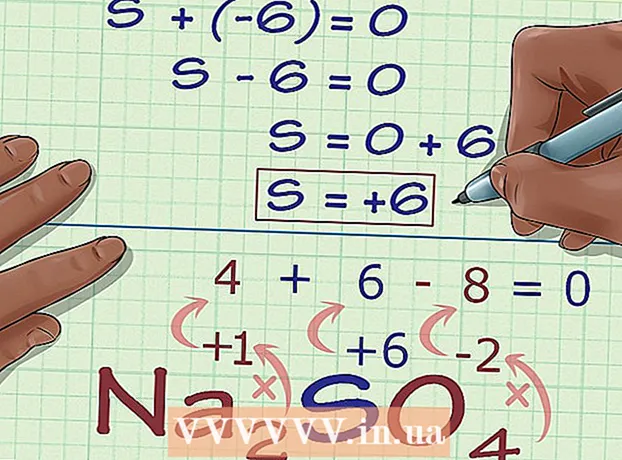
Innehåll
- Steg
- Del 1 av 2: Bestämning av oxidationstillståndet enligt kemilagarna
- Del 2 av 2: Bestämning av oxidationstillståndet utan att använda kemilagarna
- Tips
- Vad behöver du
Inom kemi betyder termen "oxidation" och "reduktion" reaktioner där en atom eller en grupp atomer förlorar respektive får elektroner. Oxidationstillståndet är ett numeriskt värde som tilldelas en eller flera atomer som karakteriserar antalet omfördelade elektroner och visar hur dessa elektroner fördelas mellan atomer under en reaktion. Bestämning av detta värde kan vara både enkelt och ganska komplext förfarande, beroende på atomerna och molekylerna som består av dem. Dessutom kan atomerna i vissa element ha flera oxidationstillstånd. Lyckligtvis finns det enkla entydiga regler för bestämning av oxidationstillståndet, för en säker användning av vilken det är tillräckligt att känna till grunderna i kemi och algebra.
Steg
Del 1 av 2: Bestämning av oxidationstillståndet enligt kemilagarna
 1 Bestäm om ämnet i fråga är elementärt. Atomernas oxidationstillstånd utanför en kemisk förening är noll. Denna regel gäller både för ämnen som bildas från separata fria atomer och för de som består av två eller polyatomiska molekyler av ett element.
1 Bestäm om ämnet i fråga är elementärt. Atomernas oxidationstillstånd utanför en kemisk förening är noll. Denna regel gäller både för ämnen som bildas från separata fria atomer och för de som består av två eller polyatomiska molekyler av ett element. - Till exempel Al(s) och Cl2 har ett oxidationstillstånd på 0, eftersom båda är i ett kemiskt obundet elementärt tillstånd.
- Observera att den allotropa formen av svavel S8, eller octacera, trots sin atypiska struktur, kännetecknas också av ett nolloxidationstillstånd.
 2 Bestäm om ämnet i fråga består av joner. Jonernas oxidationstillstånd är lika med deras laddning. Detta gäller både för fria joner och för de som ingår i kemiska föreningar.
2 Bestäm om ämnet i fråga består av joner. Jonernas oxidationstillstånd är lika med deras laddning. Detta gäller både för fria joner och för de som ingår i kemiska föreningar. - Till exempel är oxidationstillståndet för Cl -jonen -1.
- Oxidationstillståndet för Cl -jonen i den kemiska föreningen NaCl är också -1. Eftersom Na -jonen per definition har en laddning på +1, drar vi slutsatsen att laddningen av Cl -jonen är -1, och därmed dess oxidationstillstånd är -1.
 3 Observera att metalljoner kan ha flera oxidationstillstånd. Atomerna i många metalliska element kan jonisera till olika mängder. Till exempel är jonladdningen för en metall såsom järn (Fe) +2 eller +3. Laddningen av metalljoner (och deras oxidationstillstånd) kan bestämmas av laddningarna av joner av andra element med vilka denna metall är en del av en kemisk förening; i texten betecknas denna laddning med romerska siffror: till exempel har järn (III) ett oxidationstillstånd på +3.
3 Observera att metalljoner kan ha flera oxidationstillstånd. Atomerna i många metalliska element kan jonisera till olika mängder. Till exempel är jonladdningen för en metall såsom järn (Fe) +2 eller +3. Laddningen av metalljoner (och deras oxidationstillstånd) kan bestämmas av laddningarna av joner av andra element med vilka denna metall är en del av en kemisk förening; i texten betecknas denna laddning med romerska siffror: till exempel har järn (III) ett oxidationstillstånd på +3. - Som ett exempel, överväga en förening som innehåller en aluminiumjon. Total laddning av AlCl -förening3 är noll.Eftersom vi vet att Cl -joner har en laddning på -1, och föreningen innehåller 3 sådana joner, för den allmänna neutraliteten hos ämnet i fråga måste Aljonen ha en laddning på +3. Således är aluminiumoxidationstillståndet i detta fall +3.
 4 Oxidationstillståndet för syre är -2 (med vissa undantag). I nästan alla fall har syreatomer ett oxidationstillstånd på -2. Det finns flera undantag från denna regel:
4 Oxidationstillståndet för syre är -2 (med vissa undantag). I nästan alla fall har syreatomer ett oxidationstillstånd på -2. Det finns flera undantag från denna regel: - Om syre är i elementärt tillstånd (O2), dess oxidationstillstånd är 0, som i fallet med andra elementära ämnen.
- Om syre är en del av peroxid, dess oxidationstillstånd är -1. Peroxider är en grupp av föreningar som innehåller en enkel syre-syre-bindning (dvs peroxidanjonen O2). Till exempel i sammansättningen av H2O2 (väteperoxid) syre har ett laddnings- och oxidationstillstånd på -1.
- I kombination med fluor har syre ett oxidationstillstånd på +2, läs regeln för fluor nedan.
 5 Väte har ett oxidationstillstånd på +1, med några få undantag. Som med syre finns det också undantag. I regel är vätskans oxidationstillstånd +1 (om det inte är i grundtillståndet H2). I föreningar som kallas hydrider är vätens oxidationstillstånd -1.
5 Väte har ett oxidationstillstånd på +1, med några få undantag. Som med syre finns det också undantag. I regel är vätskans oxidationstillstånd +1 (om det inte är i grundtillståndet H2). I föreningar som kallas hydrider är vätens oxidationstillstånd -1. - Till exempel i H2O Väteets oxidationstillstånd är +1 eftersom syreatomen har en laddning på -2, och två +1 laddningar krävs för total neutralitet. I sammansättningen av natriumhydrid är vätens oxidationstillstånd dock redan -1, eftersom Na -jonen bär en laddning på +1, och för den allmänna elektronneutraliteten bör laddningen av väteatomen (och därmed dess oxidationstillstånd) vara -1.
 6 Fluor alltid har ett oxidationstillstånd på -1. Som redan nämnts kan oxidationstillståndet för vissa element (metalljoner, syreatomer i peroxider och så vidare) variera beroende på ett antal faktorer. Oxidationstillståndet för fluor är emellertid alltid -1. Detta beror på att detta element har störst elektronegativitet - med andra ord är fluoratomer de minst villiga att dela med sina egna elektroner och mest aktivt locka främmande elektroner. Således förblir deras avgift oförändrad.
6 Fluor alltid har ett oxidationstillstånd på -1. Som redan nämnts kan oxidationstillståndet för vissa element (metalljoner, syreatomer i peroxider och så vidare) variera beroende på ett antal faktorer. Oxidationstillståndet för fluor är emellertid alltid -1. Detta beror på att detta element har störst elektronegativitet - med andra ord är fluoratomer de minst villiga att dela med sina egna elektroner och mest aktivt locka främmande elektroner. Således förblir deras avgift oförändrad.  7 Summan av oxidationstillstånden i en förening är lika med dess laddning. Oxidationstillstånden för alla atomer som utgör en kemisk förening bör lägga till laddningen av denna förening. Till exempel, om en förening är neutral, bör summan av oxidationstillstånden för alla dess atomer vara noll; om föreningen är en polyatomisk jon med en laddning av -1, är summan av oxidationstillstånden -1, och så vidare.
7 Summan av oxidationstillstånden i en förening är lika med dess laddning. Oxidationstillstånden för alla atomer som utgör en kemisk förening bör lägga till laddningen av denna förening. Till exempel, om en förening är neutral, bör summan av oxidationstillstånden för alla dess atomer vara noll; om föreningen är en polyatomisk jon med en laddning av -1, är summan av oxidationstillstånden -1, och så vidare. - Detta är en bra testmetod - om summan av oxidationstillstånden inte motsvarar den totala laddningen av föreningen, då har du fel någonstans.
Del 2 av 2: Bestämning av oxidationstillståndet utan att använda kemilagarna
 1 Hitta atomer som inte har strikta regler för deras oxidationstillstånd. För vissa element finns det inga fastställda regler för att hitta oxidationstillståndet. Om en atom inte passar någon av reglerna ovan och du inte känner till dess laddning (till exempel är atomen en del av ett komplex och dess laddning är inte specificerad) kan du bestämma oxidationstillståndet för en sådan atom genom uteslutning. Bestäm först laddningen för alla andra atomer i föreningen och beräkna sedan oxidationstillståndet för denna atom utifrån den kända totala laddningen av föreningen.
1 Hitta atomer som inte har strikta regler för deras oxidationstillstånd. För vissa element finns det inga fastställda regler för att hitta oxidationstillståndet. Om en atom inte passar någon av reglerna ovan och du inte känner till dess laddning (till exempel är atomen en del av ett komplex och dess laddning är inte specificerad) kan du bestämma oxidationstillståndet för en sådan atom genom uteslutning. Bestäm först laddningen för alla andra atomer i föreningen och beräkna sedan oxidationstillståndet för denna atom utifrån den kända totala laddningen av föreningen. - Till exempel i föreningen Na2SÅ4 laddningen av svavelatomen (S) är okänd - vi vet bara att den inte är noll, eftersom svavel inte är i ett elementärt tillstånd. Denna förening fungerar som ett bra exempel för att illustrera den algebraiska metoden för att bestämma oxidationstillståndet.
 2 Hitta oxidationstillstånden för de återstående elementen i föreningen. Bestäm oxidationstillstånden för de återstående atomerna i föreningen med hjälp av de regler som beskrivs ovan. Glöm inte undantagen från regeln för O, H, och så vidare.
2 Hitta oxidationstillstånden för de återstående elementen i föreningen. Bestäm oxidationstillstånden för de återstående atomerna i föreningen med hjälp av de regler som beskrivs ovan. Glöm inte undantagen från regeln för O, H, och så vidare. - För Na2SÅ4, med hjälp av våra regler, finner vi att laddningen (och därmed oxidationstillståndet) för Na -jonen är +1, och för var och en av syreatomerna är den -2.
 3 Multiplicera antalet atomer med deras oxidationstillstånd. Nu när vi känner till oxidationstillstånden för alla atomer utom en, är det nödvändigt att ta hänsyn till att det kan finnas flera atomer av vissa element. Multiplicera antalet atomer för varje grundämne (det anges i föreningens kemiska formel som ett abonnemang efter elementets symbol) med dess oxidationstillstånd.
3 Multiplicera antalet atomer med deras oxidationstillstånd. Nu när vi känner till oxidationstillstånden för alla atomer utom en, är det nödvändigt att ta hänsyn till att det kan finnas flera atomer av vissa element. Multiplicera antalet atomer för varje grundämne (det anges i föreningens kemiska formel som ett abonnemang efter elementets symbol) med dess oxidationstillstånd. - I Na2SÅ4 vi har 2 Na -atomer och 4 atomer. Således, multiplicerar vi 2 × +1, får vi oxidationstillståndet för alla Na -atomer (2) och multiplicerar 4 × -2 -oxidationstillståndet för O (-8) atomerna.
 4 Lägg ihop de tidigare resultaten. När vi summerar resultaten av multiplikation får vi oxidationstillståndet för föreningen utan med hänsyn till bidraget från den önskade atomen.
4 Lägg ihop de tidigare resultaten. När vi summerar resultaten av multiplikation får vi oxidationstillståndet för föreningen utan med hänsyn till bidraget från den önskade atomen. - I vårt exempel, för Na2SÅ4 vi lägger till 2 och -8 och får -6.
 5 Hitta det okända oxidationstillståndet från föreningens laddning. Du har nu alla data för att enkelt beräkna önskat oxidationstillstånd. Skriv ner en ekvation, till vänster om vilken kommer summan av antalet erhållna i föregående beräkningssteg och det okända oxidationstillståndet, och på höger sida av den totala laddningen av föreningen. Med andra ord, (Summan av kända oxidationstillstånd) + (önskat oxidationstillstånd) = (laddning av en förening).
5 Hitta det okända oxidationstillståndet från föreningens laddning. Du har nu alla data för att enkelt beräkna önskat oxidationstillstånd. Skriv ner en ekvation, till vänster om vilken kommer summan av antalet erhållna i föregående beräkningssteg och det okända oxidationstillståndet, och på höger sida av den totala laddningen av föreningen. Med andra ord, (Summan av kända oxidationstillstånd) + (önskat oxidationstillstånd) = (laddning av en förening).- I vårt fall, Na2SÅ4 lösningen ser ut så här:
- (Summan av kända oxidationstillstånd) + (önskat oxidationstillstånd) = (sammansatt laddning)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2SÅ4 svavel har ett oxidationstillstånd 6.
- I vårt fall, Na2SÅ4 lösningen ser ut så här:
Tips
- I föreningar måste summan av alla oxidationstillstånd vara lika med laddningen. Om föreningen till exempel är en diatomisk jon måste summan av oxidationstillstånden för atomerna motsvara den totala jonladdningen.
- Det är mycket användbart att kunna använda det periodiska systemet och veta var de metalliska och icke-metalliska elementen finns i det.
- Atomernas oxidationstillstånd i elementär form är alltid noll. Oxidationstillståndet för en enda jon är lika med dess laddning. Element i grupp 1A i det periodiska systemet, såsom väte, litium, natrium, i elementär form har ett oxidationstillstånd på +1; Oxidationstillståndet för grupp 2A -metaller, såsom magnesium och kalcium, är +2 i elementär form. Syre och väte, beroende på typen av kemisk bindning, kan ha 2 olika oxidationstillstånd.
Vad behöver du
- Periodiska systemet med element
- Tillgång till internet eller referensböcker om kemi
- Ett papper, penna eller penna
- Kalkylator