Författare:
Florence Bailey
Skapelsedatum:
21 Mars 2021
Uppdatera Datum:
1 Juli 2024
Innehåll
- Steg
- Metod 1 av 2: Distribution av elektroner med hjälp av det periodiska systemet av D. I. Mendeleev
- Metod 2 av 2: Använda ADOMAHs periodiska system
- Tips
Elektronisk konfiguration en atom är en numerisk representation av dess elektronorbitaler. Elektroniska orbitaler är regioner av olika former som ligger runt en atomkärna där en elektron är matematiskt trolig. Elektronisk konfiguration hjälper till att snabbt och enkelt berätta för läsaren hur många elektronorbitaler en atom har, samt bestämma antalet elektroner i varje orbital. Efter att ha läst den här artikeln kommer du att behärska metoden för att generera elektroniska konfigurationer.
Steg
Metod 1 av 2: Distribution av elektroner med hjälp av det periodiska systemet av D. I. Mendeleev
 1 Hitta atomens atomnummer. Varje atom har ett specifikt antal elektroner associerade med den. Hitta symbolen för din atom i det periodiska systemet. Ett atomnummer är ett positivt heltal som börjar vid 1 (för väte) och ökar med ett för varje efterföljande atom. Ett atomnummer är antalet protoner i en atom, och därför är det också antalet elektroner i en atom med nolladdning.
1 Hitta atomens atomnummer. Varje atom har ett specifikt antal elektroner associerade med den. Hitta symbolen för din atom i det periodiska systemet. Ett atomnummer är ett positivt heltal som börjar vid 1 (för väte) och ökar med ett för varje efterföljande atom. Ett atomnummer är antalet protoner i en atom, och därför är det också antalet elektroner i en atom med nolladdning. - 2 Bestäm laddningen av en atom. Neutrala atomer kommer att ha samma antal elektroner som visas i det periodiska systemet. Emellertid kommer laddade atomer att ha fler eller färre elektroner, beroende på mängden laddning. Om du arbetar med en laddad atom, lägg till eller subtrahera elektroner enligt följande: lägg till en elektron för varje negativ laddning och subtrahera en för varje positiv.
- Till exempel kommer en natriumatom med en laddning på -1 att ha en extra elektron för övrigt till basens atomnummer 11. Med andra ord kommer den totala atomen att ha 12 elektroner.
- Om vi talar om en natriumatom med en laddning på +1, måste en elektron subtraheras från basatomen 11. Således kommer atomen att ha 10 elektroner.
- 3 Kom ihåg den grundläggande listan över orbitaler. När antalet elektroner ökar fyller de de olika undernivåerna i atomens elektronskal enligt en viss sekvens. Varje delnivå i elektronskalet, när det är fyllt, innehåller ett jämnt antal elektroner. Följande undernivåer är tillgängliga:
- s-undernivå (alla nummer i den elektroniska konfigurationen som kommer före bokstaven "s") innehåller en enda omloppsbana, och, enligt Paulis princip, kan en orbital innehålla högst 2 elektroner, därför kan det finnas 2 elektroner på varje s-undernivå i elektronskalet.
- p-undernivå innehåller 3 orbitaler och kan därför innehålla högst 6 elektroner.
- d-undernivå innehåller 5 orbitaler, så den kan ha upp till 10 elektroner.
- f-undernivå innehåller 7 orbitaler, så den kan ha upp till 14 elektroner.
- g-, h-, i- och k-undernivåer är teoretiska. Atomerna som innehåller elektroner i dessa orbitaler är okända. G-undernivån innehåller 9 orbitaler, så teoretiskt sett kan den ha 18 elektroner. H-undernivån kan ha 11 orbitaler och högst 22 elektroner; i i -sub -nivå -13 orbitaler och högst 26 elektroner; i k -undernivån - 15 orbitaler och högst 30 elektroner.
- Memorera orbitalernas ordning med mnemoniska tricket:
Sober Physiker Dpå Find Giraffes Hiding In Kkliar (nykter fysiker hittar inte giraffer som gömmer sig i kök).
- 4 Förstå den elektroniska konfigurationsposten. Elektroniska konfigurationer registreras för att tydligt återspegla antalet elektroner i varje orbital. Orbitaler skrivs sekventiellt, varvid antalet atomer i varje orbital är överskrift till höger om orbitalnamnet. Den färdiga elektroniska konfigurationen har formen av en sekvens av undernivåbeteckningar och överskrift.
- Till exempel den enklaste elektroniska konfigurationen: 1s 2s 2p. Denna konfiguration visar att det finns två elektroner vid 1: s undernivå, två elektroner på 2: s undernivå och sex elektroner på 2p: s undernivå. 2 + 2 + 6 = totalt 10 elektroner. Detta är den elektroniska konfigurationen av en neutral neonatom (neonatomen är 10).
- 5 Kom ihåg orbitalernas ordning. Tänk på att elektronorbitalerna är numrerade i stigande ordning på elektronskalnumret, men i stigande energiordning. Till exempel är en fylld 4s orbital mindre energisk (eller mindre mobil) än en delvis fylld eller fylld 3d, så 4s orbital registreras först. När du väl känner till orbitalernas ordning kan du enkelt fylla i dem enligt antalet elektroner i atomen. Ordningen för att fylla orbitalerna är följande: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Den elektroniska konfigurationen av en atom där alla orbitaler är fyllda kommer att ha följande form: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Observera att posten ovan, när alla orbitaler är fyllda, är den elektroniska konfigurationen av elementet Uuo (ununoctium) 118, den högsta numrerade atomen i det periodiska systemet. Därför innehåller denna elektroniska konfiguration alla för närvarande kända elektroniska undernivåer för en neutralt laddad atom.
- 6 Fyll i orbitalerna enligt antalet elektroner i din atom. Till exempel, om vi vill skriva ner den elektroniska konfigurationen av en neutral kalciumatom, måste vi börja med att leta efter dess atomnummer i det periodiska systemet. Dess atomnummer är 20, så vi kommer att skriva konfigurationen av en atom med 20 elektroner enligt ovanstående ordning.
- Fyll i orbitalerna i ordningen ovan tills du når den tjugonde elektronen. Den första 1s -orbitalen kommer att innehålla två elektroner, 2s -orbitalerna kommer också att ha två, 2p - sex, 3s - två, 3p - 6 och 4s - 2 (2 + 2 + 6 +2 + 6 + 2 = 20.) I med andra ord, den elektroniska konfigurationen av kalcium är: 1s 2s 2p 3s 3p 4s.
- Observera att orbitalerna är i stigande energiordning. Till exempel, när du är redo att gå till den fjärde energinivån, skriv sedan först ner 4: orbanan och sedan 3d. Efter den fjärde energinivån går du till den femte, där samma ordning upprepas. Detta händer först efter den tredje energinivån.
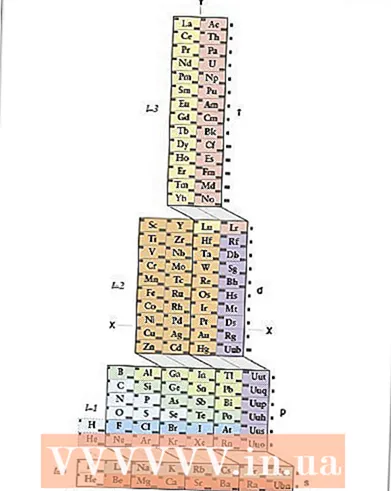
- 7 Använd det periodiska systemet som en visuell ledtråd. Du har säkert redan märkt att det periodiska systemets form motsvarar ordningen för elektroniska undernivåer i elektroniska konfigurationer. Till exempel slutar atomerna i den andra kolumnen från vänster alltid med "s", medan atomerna på högerkanten av den tunna mellersta sektionen alltid slutar med "d", och så vidare. Använd det periodiska systemet som en visuell guide för att skriva konfigurationer - eftersom den ordning som du lägger till orbitaler motsvarar din position i tabellen. Se nedan:
- I synnerhet innehåller de två kolumnerna längst till vänster atomer vars elektroniska konfigurationer slutar i s-orbitaler, tabellens högra block innehåller atomer vars konfigurationer slutar i p-orbitaler och i den nedre delen atomer slutar i f-orbitaler.
- Till exempel, när du skriver ner den elektroniska konfigurationen av klor, tänk så här: "Denna atom är belägen i den tredje raden (eller" perioden ") i det periodiska systemet. Den ligger också i den femte gruppen i p -orbitalblocket av det periodiska systemet. Därför slutar dess elektroniska konfiguration i .3p
- Observera: elementen i området för d och f orbitaler i tabellen kännetecknas av energinivåer som inte motsvarar den period de befinner sig i. Till exempel motsvarar den första raden i blocket av element med d-orbitaler 3d-orbitaler, även om den ligger i den fjärde perioden, och den första raden med element med f-orbitaler motsvarar 4f-orbitalen, trots att den är är i den 6: e perioden.
- 8 Lär dig stenografi för att skriva långa elektroniska konfigurationer. Atomerna på det högra kanten av det periodiska systemet kallas ädelgaser. Dessa element är kemiskt mycket stabila. För att förkorta processen med att skriva långa elektroniska konfigurationer, skriv helt enkelt inom hakparenteser den kemiska symbolen för den närmaste ädelgasen med färre elektroner än din atom, och fortsätt sedan skriva den elektroniska konfigurationen av efterföljande orbitalnivåer. Se nedan:
- För att förstå detta koncept är det bra att skriva en exempelkonfiguration. Låt oss skriva konfigurationen för zink (atomnummer 30) med hjälp av ädelgasförkortningen. Den fullständiga zinkkonfigurationen ser ut så här: 1s 2s 2p 3s 3p 4s 3d. Vi ser dock att 1s 2s 2p 3s 3p är den elektroniska konfigurationen av argon, en ädelgas. Ersätt helt enkelt den elektroniska konfigurationsdelen av zink med den kemiska symbolen argon inom hakparenteser ([Ar].)
- Så den elektroniska konfigurationen av zink, skriven i en förkortad form, är: [Ar] 4s 3d.
- Observera att om du skriver den elektroniska konfigurationen av en ädelgas, säg argon, kan du inte skriva [Ar]! Man måste använda reduktionen av den ädelgas som vetter mot detta element; för argon blir det neon ([Ne]).
Metod 2 av 2: Använda ADOMAHs periodiska system
 1 Lär dig det periodiska systemet ADOMAH. Denna metod för registrering av den elektroniska konfigurationen kräver inte memorering, men den kräver en reviderad periodisk tabell, eftersom i den traditionella periodiska tabellen, från och med den fjärde perioden, motsvarar periodnumret inte elektronskalet. Hitta ADOMAH Periodic Table - en speciell typ av periodiska system som utvecklats av forskaren Valery Zimmerman. Det är lätt att hitta det med en kort sökning på Internet.
1 Lär dig det periodiska systemet ADOMAH. Denna metod för registrering av den elektroniska konfigurationen kräver inte memorering, men den kräver en reviderad periodisk tabell, eftersom i den traditionella periodiska tabellen, från och med den fjärde perioden, motsvarar periodnumret inte elektronskalet. Hitta ADOMAH Periodic Table - en speciell typ av periodiska system som utvecklats av forskaren Valery Zimmerman. Det är lätt att hitta det med en kort sökning på Internet. - I det periodiska systemet för ADOMAH representerar horisontella rader grupper av element som halogener, ädelgaser, alkalimetaller, jordalkalimetaller, etc. Vertikala kolumner motsvarar elektroniska nivåer, och så kallade "kaskader" (diagonala linjer som förbinder block s, p, d och f) motsvarar perioder.
- Helium flyttas till väte eftersom båda dessa element har en 1s -omlopp. Periodblock (s, p, d och f) visas på höger sida och nivånummer visas längst ner. Element visas i rutor numrerade 1 till 120. Dessa nummer är vanliga atomnummer som representerar det totala antalet elektroner i en neutral atom.
- 2 Hitta din atom i tabellen ADOMAH. För att spela in den elektroniska konfigurationen av ett element, hitta dess symbol i ADOMAHs periodiska system och stryk alla element med ett högre atomnummer. Om du till exempel behöver skriva ner den elektroniska konfigurationen av erbium (68), streckar du alla element från 69 till 120.
- Notera siffrorna 1 till 8 längst ner i tabellen. Dessa är elektroniska nivånummer eller kolumnnummer. Ignorera kolumner som bara innehåller streckade objekt.För erbium finns kolumnerna numrerade 1, 2, 3, 4, 5 och 6 kvar.
- 3 Räkna de orbitala undernivåerna till ditt element. Om du tittar på blocksymbolerna som visas till höger om tabellen (s, p, d och f) och kolumnnumren som visas längst ner, ignorerar du de diagonala linjerna mellan blocken och bryter kolumnerna i kolumnblock i ordning från botten till toppen. Ignorera igen rutorna med alla element streckade. Skriv ner kolumnblocken, börja med kolumnnumret följt av blocksymbolen, alltså: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (för erbium).
- Obs! Ovanstående elektroniska konfiguration Er skrivs i stigande ordning efter det elektroniska delnivånumret. Det kan också skrivas i ordningen att fylla orbitalerna. För att göra detta, följ kaskaderna nedifrån och upp, inte kolumnerna när du skriver kolumnblocken: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- 4 Räkna elektronerna för varje elektronisk delnivå. Räkna elementen i varje blockkolumn som inte var överstrukna, fäst en elektron från varje element och skriv deras nummer bredvid blocksymbolen för varje blockkolumn enligt följande: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s ... I vårt exempel är detta den elektroniska konfigurationen av erbium.
- 5 Tänk på felaktiga elektroniska konfigurationer. Det finns arton typiska undantag relaterade till de elektroniska konfigurationerna av atomer i det lägsta energitillståndet, även kallat grundenergistillståndet. De följer inte den allmänna regeln bara i de två eller tre sista positionerna som elektronerna innehar. I detta fall antar den faktiska elektroniska konfigurationen att elektronerna befinner sig i ett tillstånd med en lägre energi i jämförelse med atomens standardkonfiguration. Undantagsatomer inkluderar:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) och Centimeter (..., 5f7, 6d1, 7s2).
Tips
- För att hitta atomnummer för en atom när den är skriven i elektronisk konfiguration, lägg helt enkelt ihop alla siffror som följer bokstäverna (s, p, d och f). Detta fungerar bara för neutrala atomer, om du har att göra med en jon kommer ingenting att fungera - du måste lägga till eller subtrahera antalet extra eller förlorade elektroner.
- Siffran efter bokstaven är en överskrift, gör inte ett misstag i kontrollen.
- Det finns ingen "stabilitet för en halvfylld" delnivå. Detta är en förenkling. All stabilitet som hänför sig till de "halvfyllda" undernivåerna beror på det faktum att varje omlopp upptar en elektron, så avstötningen mellan elektronerna minimeras.
- Varje atom tenderar till ett stabilt tillstånd, och de mest stabila konfigurationerna har fyllt undernivåer s och p (s2 och p6). Ädelgaser har en sådan konfiguration, därför kommer de sällan i reaktioner och ligger till höger i det periodiska systemet. Därför, om konfigurationen slutar vid 3p, behöver den två elektroner för att nå ett stabilt tillstånd (för att förlora sex, inklusive elektroner i s-undernivån, krävs mer energi, så det är lättare att förlora fyra). Och om konfigurationen slutar på 4d måste den förlora tre elektroner för att nå ett stabilt tillstånd. Dessutom är halvfyllda undernivåer (s1, p3, d5 ..) mer stabila än till exempel p4 eller p2; s2 och p6 blir dock ännu mer robusta.
- När du har att göra med en jon betyder det att antalet protoner inte är lika med antalet elektroner. I detta fall visas laddningen av en atom längst upp till höger (som regel) i den kemiska symbolen. Därför har en antimonatom med en laddning på +2 den elektroniska konfigurationen 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Observera att 5p har ändrats till 5p. Var försiktig när konfigurationen av en neutral atom hamnar på andra undernivåer än s och p. När du plockar upp elektroner kan du bara plocka upp dem från valensorbitalerna (s och p orbitaler).Därför, om konfigurationen slutar vid 4s 3d och atomen får en +2 laddning, kommer konfigurationen att sluta med 4s 3d. Observera att 3d inte förändringar, istället för att förlora s-orbitalelektroner.
- Det finns förhållanden när elektronen tvingas "gå till en högre energinivå." När en undernivå saknar en elektron till halv eller full fyllning, ta en elektron från närmaste s eller p-undernivå och flytta den till den undernivå som behöver en elektron.
- Det finns två alternativ för inspelning av en elektronisk konfiguration. De kan skrivas i stigande ordning av energinivånummer eller i ordningen för fyllning av elektronorbitaler, som visades ovan för erbium.
- Du kan också skriva ner den elektroniska konfigurationen av ett element genom att bara skriva ner valenskonfigurationen, som är de sista s- och p -undernivåerna. Således kommer valenskonfigurationen av antimon att ha formen 5s 5p.
- Jonas är inte densamma. Det är mycket svårare med dem. Hoppa över två nivåer och följ samma mönster beroende på var du började och hur stort antalet elektroner är.