Författare:
Clyde Lopez
Skapelsedatum:
26 Juli 2021
Uppdatera Datum:
1 Juli 2024
Innehåll
- Steg
- Metod 1 av 4: Beräkning av procent med hjälp av en vikt / volymformel
- Metod 2 av 4: Framställning av en molekylär lösning
- Metod 3 av 4: Spädning av lösningar av känd koncentration
- Metod 4 av 4: Överensstämmelse med säkerhetsåtgärder
- Tips
- Varningar
- Vad behöver du
Enkla kemiska lösningar kan enkelt förberedas på olika sätt hemma eller på jobbet. Oavsett om du gör en lösning av ett pulverformigt material eller späd en vätska, är det lätt att bestämma rätt mängd av varje komponent. När du förbereder kemiska lösningar, kom ihåg att använda personlig skyddsutrustning för att undvika skador.
Steg
Metod 1 av 4: Beräkning av procent med hjälp av en vikt / volymformel
 1 Definiera procentsats innehåll på vikt/ volym lösning. Procenttal visar hur många delar av ett ämne som finns i hundra delar av en lösning. När det appliceras på kemiska lösningar betyder det att om koncentrationen är 1 procent innehåller 100 milliliter lösning 1 gram av ämnet, det vill säga 1 ml / 100 ml.
1 Definiera procentsats innehåll på vikt/ volym lösning. Procenttal visar hur många delar av ett ämne som finns i hundra delar av en lösning. När det appliceras på kemiska lösningar betyder det att om koncentrationen är 1 procent innehåller 100 milliliter lösning 1 gram av ämnet, det vill säga 1 ml / 100 ml. - Till exempel, i vikt: En lösning på 10 viktprocent innehåller 10 gram av ämnet löst i 100 milliliter lösning.
- Till exempel, i volym: En 23 volymprocent lösning innehåller 23 milliliter flytande förening i varje 100 milliliter lösning.
 2 Bestäm volymen på lösningen du vill förbereda. För att ta reda på den nödvändiga massan av ett ämne måste du först bestämma den slutliga volymen av lösningen du behöver. Denna volym beror på hur mycket lösning du behöver, hur ofta du kommer att använda den och stabiliteten hos den färdiga lösningen.
2 Bestäm volymen på lösningen du vill förbereda. För att ta reda på den nödvändiga massan av ett ämne måste du först bestämma den slutliga volymen av lösningen du behöver. Denna volym beror på hur mycket lösning du behöver, hur ofta du kommer att använda den och stabiliteten hos den färdiga lösningen. - Om du behöver använda en ny lösning varje gång, förbered bara den mängd du behöver för en användning.
- Om lösningen behåller sina egenskaper under lång tid kan du förbereda en större mängd för att använda den senare.
- Exempel: Du måste bereda en 5% NaCl -lösning med en volym på 500 ml.
 3 Beräkna antalet gram av ämnet som krävs för att bereda lösningen. För att beräkna det erforderliga antalet gram, använd följande formel: antal gram = (procent krävs) (erforderlig volym / 100 ml). I detta fall uttrycks de erforderliga procentsatserna i gram och den erforderliga volymen i milliliter.
3 Beräkna antalet gram av ämnet som krävs för att bereda lösningen. För att beräkna det erforderliga antalet gram, använd följande formel: antal gram = (procent krävs) (erforderlig volym / 100 ml). I detta fall uttrycks de erforderliga procentsatserna i gram och den erforderliga volymen i milliliter. - Exempel: Du måste bereda en 5% NaCl -lösning med en volym på 500 ml.
- antal gram = (5g) (500ml / 100ml) = 25 gram.
- Om NaCl ges som en lösning, ta helt enkelt 25 ml NaCl istället för gram pulver och subtrahera volymen från slutvolymen: 25 milliliter NaCl till 475 milliliter vatten.
 4 Väg ämnet. När du har beräknat den nödvändiga massan av ämnet bör du mäta denna mängd. Ta en kalibrerad skala, lägg en skål på den och ställ noll. Väg den nödvändiga mängden ämne i gram och häll ut det.
4 Väg ämnet. När du har beräknat den nödvändiga massan av ämnet bör du mäta denna mängd. Ta en kalibrerad skala, lägg en skål på den och ställ noll. Väg den nödvändiga mängden ämne i gram och häll ut det. - Innan du fortsätter att förbereda lösningen, se till att rengöra vägningsformen för eventuella pulverrester.
- I exemplet ovan måste du väga 25 gram NaCl.
 5 Lös upp ämnet i erforderlig mängd vätska. Om inget annat anges används vatten som lösningsmedel. Ta ett mätglas och mät den mängd vätska som krävs. Lös sedan upp pulvermaterialet i vätskan.
5 Lös upp ämnet i erforderlig mängd vätska. Om inget annat anges används vatten som lösningsmedel. Ta ett mätglas och mät den mängd vätska som krävs. Lös sedan upp pulvermaterialet i vätskan. - Signera behållaren där lösningen ska lagras. Ange tydligt ämnet och dess koncentration på det.
- Exempel: Lös 25 gram NaCl i 500 milliliter vatten för att få en 5% lösning.
- Kom ihåg att om du spädar en flytande substans, för att få den mängd vatten som krävs, subtrahera volymen av det tillsatta ämnet från slutvolymen av lösningen: 500 ml - 25 ml = 475 ml vatten.
Metod 2 av 4: Framställning av en molekylär lösning
 1 Bestäm molekylvikten för det ämne som används med hjälp av formeln. Formelvikten (eller helt enkelt molekylvikten) för en förening är skriven i gram per mol (g / mol) på flaskväggen. Om du inte hittar molekylvikten på flaskan, leta online.
1 Bestäm molekylvikten för det ämne som används med hjälp av formeln. Formelvikten (eller helt enkelt molekylvikten) för en förening är skriven i gram per mol (g / mol) på flaskväggen. Om du inte hittar molekylvikten på flaskan, leta online. - Molekylvikten för ett ämne är massan (i gram) av en mol av ämnet.
- Exempel: Molekylvikten av natriumklorid (NaCl) är 58,44 g / mol.
 2 Bestäm volymen av den önskade lösningen i liter. Det är mycket enkelt att förbereda en liter lösning, eftersom molariteten uttrycks i mol / liter, men det kan vara nödvändigt att göra mer eller mindre liter, beroende på syftet med lösningen. Använd den slutliga volymen för att beräkna det erforderliga antalet gram.
2 Bestäm volymen av den önskade lösningen i liter. Det är mycket enkelt att förbereda en liter lösning, eftersom molariteten uttrycks i mol / liter, men det kan vara nödvändigt att göra mer eller mindre liter, beroende på syftet med lösningen. Använd den slutliga volymen för att beräkna det erforderliga antalet gram. - Exempel: det är nödvändigt att bereda 50 ml av en lösning med en molfraktion av NaCl av 0,75.
- För att omvandla milliliter till liter, dela dem med 1000 och få 0,05 liter.
 3 Beräkna antalet gram som krävs för att förbereda den nödvändiga molekylära lösningen. För att göra detta, använd följande formel: antal gram = (erforderlig volym) (krävs molaritet) (molekylvikt enligt formeln). Kom ihåg att den erforderliga volymen uttrycks i liter, molariteten är i mol per liter och molekylvikten enligt formeln är i gram per mol.
3 Beräkna antalet gram som krävs för att förbereda den nödvändiga molekylära lösningen. För att göra detta, använd följande formel: antal gram = (erforderlig volym) (krävs molaritet) (molekylvikt enligt formeln). Kom ihåg att den erforderliga volymen uttrycks i liter, molariteten är i mol per liter och molekylvikten enligt formeln är i gram per mol. - Exempel: om du vill bereda 50 milliliter av en lösning med en molfraktion av NaCl 0,75 (molekylvikt enligt formeln: 58,44 g / mol), bör du beräkna antalet gram NaCl.
- antal gram = 0,05 l * 0,75 mol / l * 58,44 g / mol = 2,19 gram NaCl.
- Genom att minska måttenheterna får du gram ämne.
 4 Väg ämnet. Avväg önskad mängd med en korrekt kalibrerad balans. Placera en skål på balansen och noll innan vägning. Lägg ämnet i skålen tills du når önskad massa.
4 Väg ämnet. Avväg önskad mängd med en korrekt kalibrerad balans. Placera en skål på balansen och noll innan vägning. Lägg ämnet i skålen tills du når önskad massa. - Rengör vågskålen efter användning.
- Exempel: Väg 2,19 gram NaCl.
 5 Lös upp pulvret i erforderlig mängd vätska. Om inte annat anges använder de flesta lösningar vatten. I detta fall tas samma volym vätska som användes för att beräkna ämnets massa. Tillsätt ämnet i vatten och rör om tills det är helt upplöst.
5 Lös upp pulvret i erforderlig mängd vätska. Om inte annat anges använder de flesta lösningar vatten. I detta fall tas samma volym vätska som användes för att beräkna ämnets massa. Tillsätt ämnet i vatten och rör om tills det är helt upplöst. - Signera behållaren med lösningen. Märk upplösningen och molariteten tydligt så att du kan använda lösningen senare.
- Exempel: Använd en bägare (volymmätinstrument) för att mäta upp 50 ml vatten och lösa upp 2,19 gram NaCl i den.
- Rör om lösningen tills pulvret är helt upplöst.
Metod 3 av 4: Spädning av lösningar av känd koncentration
 1 Bestäm koncentrationen av varje lösning. Vid utspädning av lösningar måste du veta koncentrationen av den ursprungliga lösningen och den lösning du vill erhålla.Denna metod är lämplig för utspädning av koncentrerade lösningar.
1 Bestäm koncentrationen av varje lösning. Vid utspädning av lösningar måste du veta koncentrationen av den ursprungliga lösningen och den lösning du vill erhålla.Denna metod är lämplig för utspädning av koncentrerade lösningar. - Exempel: Bered 75 milliliter 1,5 M NaCl -lösning från en 5 M. lösning. Stamlösningen har en koncentration på 5 M och det är nödvändigt att späda ut den till en koncentration av 1,5 M.
 2 Bestäm volymen på den slutliga lösningen. Det är nödvändigt att hitta volymen på lösningen som du vill få. Du måste beräkna mängden lösning som kommer att krävas för att späda ut denna lösning till önskad koncentration och volym.
2 Bestäm volymen på den slutliga lösningen. Det är nödvändigt att hitta volymen på lösningen som du vill få. Du måste beräkna mängden lösning som kommer att krävas för att späda ut denna lösning till önskad koncentration och volym. - Exempel: Bered 75 ml av en 1,5 M NaCl -lösning från en initial 5 M. lösning. I detta exempel är den slutliga lösningsvolymen 75 milliliter.
 3 Beräkna volymen lösning som behövs för att späda ut startlösningen. För att göra detta behöver du följande formel: V1C1= V2C2där V1 - volymen av den önskade lösningen, C1 - dess koncentration, V2 - den slutliga lösningens volym, C2 - hans koncentration.
3 Beräkna volymen lösning som behövs för att späda ut startlösningen. För att göra detta behöver du följande formel: V1C1= V2C2där V1 - volymen av den önskade lösningen, C1 - dess koncentration, V2 - den slutliga lösningens volym, C2 - hans koncentration. - För att beräkna volymen av den nödvändiga vätskan är det nödvändigt att skriva om jämlikheten med avseende på V1: V1 = (V2C2) / C1.
- Exempel: Du måste bereda en 75 ml lösning av NaCl med en koncentration av 1,5 M från en lösning med en koncentration av 5 M.
- V1 = (V2C2) / C1 = (0,075 l * 1,5 M) / 5M = 0,0225 l.
- Omvandla liter tillbaka till milliliter genom att multiplicera med 1000 för att få 22,5 milliliter.
 4 Subtrahera volymen för den ursprungliga lösningen från den planerade slutvolymen. Som ett resultat av utspädning av lösningen är det nödvändigt att erhålla en fast slutvolym. Subtrahera volymen av stamlösningen från den slutliga volymen för att bestämma volymen av utspädningslösningen.
4 Subtrahera volymen för den ursprungliga lösningen från den planerade slutvolymen. Som ett resultat av utspädning av lösningen är det nödvändigt att erhålla en fast slutvolym. Subtrahera volymen av stamlösningen från den slutliga volymen för att bestämma volymen av utspädningslösningen. - Exempel: Den slutliga volymen är 75 milliliter och den ursprungliga volymen är 22,5 milliliter. Således får vi 75 - 22,5 = 52,5 milliliter. Det är denna vätskemängd som kommer att behövas för att späda lösningen.
 5 Blanda den beräknade mängden stamlösning med utspädningsvätskan. Använd en bägare (instrument för att mäta vätskevolymen), mäta ut den erforderliga mängden stamlösning och blanda den med den önskade volymen av utspädningsvätskan.
5 Blanda den beräknade mängden stamlösning med utspädningsvätskan. Använd en bägare (instrument för att mäta vätskevolymen), mäta ut den erforderliga mängden stamlösning och blanda den med den önskade volymen av utspädningsvätskan. - Exempel: Mät upp 22,5 milliliter av en 5 M NaCl -stamlösning och späd med 52,5 milliliter vatten. Rör om lösningen.
- Skriv på behållaren med den utspädda lösningen dess koncentration och sammansättning: 1,5 M NaCl.
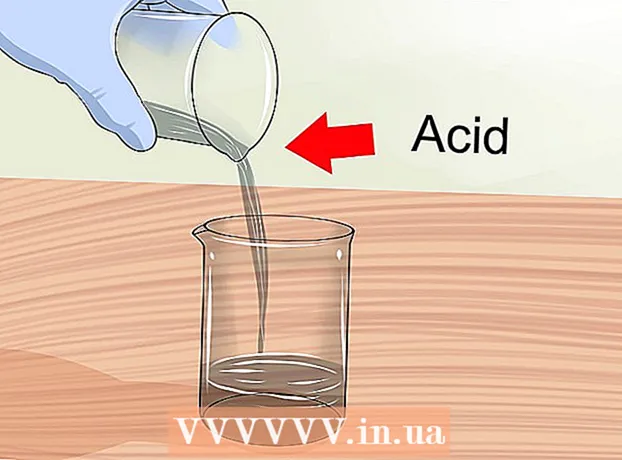
- Kom ihåg att om du spädar syra med vatten bör du tillsätta syra i vattnet, men aldrig tvärtom.
Metod 4 av 4: Överensstämmelse med säkerhetsåtgärder
 1 Använd personlig skyddsutrustning. Vid arbete med aggressiva kemikalier och lösningar, skydda mot deras effekter. Var noga med att bära en labrock, slutna skor, skyddsglasögon och handskar.
1 Använd personlig skyddsutrustning. Vid arbete med aggressiva kemikalier och lösningar, skydda mot deras effekter. Var noga med att bära en labrock, slutna skor, skyddsglasögon och handskar. - Använd en labcoat av obrännbart material.
- Skyddsglasögon ska ha sidoskydd som täcker ögonen från sidan.
 2 Arbeta i ett välventilerat område. När lösningarna blandas kan flyktiga gaser släppas ut. Vissa ämnen ska endast hanteras under en laboratoriekåpa. Om du blandar lösningar hemma, öppna fönster och slå på en fläkt för att säkerställa tillräcklig luftcirkulation.
2 Arbeta i ett välventilerat område. När lösningarna blandas kan flyktiga gaser släppas ut. Vissa ämnen ska endast hanteras under en laboratoriekåpa. Om du blandar lösningar hemma, öppna fönster och slå på en fläkt för att säkerställa tillräcklig luftcirkulation.  3 Tillsätt syra i vatten. Vid utspädning av koncentrerade syror, tillsätt alltid syran i vattnet. När vatten och syra blandas uppstår en exoterm reaktion (med frisättning av värme), som kan leda till en explosion om vatten tillsätts till syran, och inte tvärtom.
3 Tillsätt syra i vatten. Vid utspädning av koncentrerade syror, tillsätt alltid syran i vattnet. När vatten och syra blandas uppstår en exoterm reaktion (med frisättning av värme), som kan leda till en explosion om vatten tillsätts till syran, och inte tvärtom. - Kom ihåg säkerhetsåtgärderna varje gång du arbetar med syror.
Tips
- Bekanta dig med ämnet innan du börjar. Kunskap är makt!
- Prova att använda vanliga hushållsprodukter. Försök inte göra något extraordinärt. Om du misstänker att det kan uppstå en fara, ge upp.
Varningar
- Blanda inte blekmedel och ammoniak.
- Använd säkerhetsutrustning, skyddsglasögon, ett plastförkläde och neoprenhandskar efter behov.
Vad behöver du
- Exakta mekaniska eller elektroniska vågar för att bestämma massan. Till exempel kan du använda en köksvåg.
- Graduerat glas. Dessa redskap kan hittas i en köksbutik eller beställas online. Mätglas finns i en mängd olika former och storlekar. Plastskålar fungerar, även om de inte tål höga temperaturer.