Författare:
Monica Porter
Skapelsedatum:
22 Mars 2021
Uppdatera Datum:
1 Juli 2024
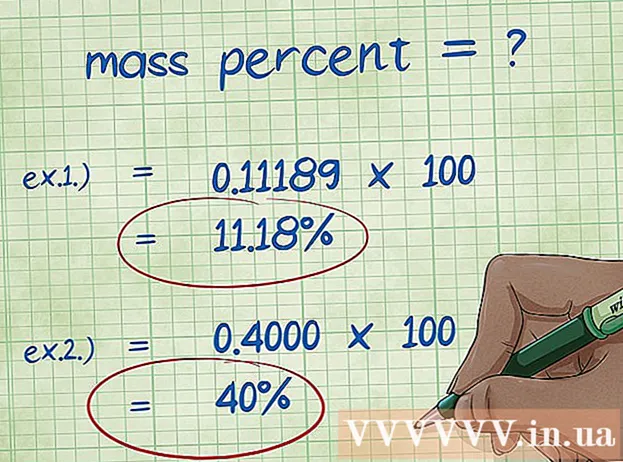
Innehåll
Massprocent anger procentandelen av varje grundämne i en kemisk förening. För att hitta massprocent måste man känna till molmassan för elementen i föreningen i gram / mol eller antalet gram av de ämnen som utgör lösningen. Massprocenten beräknas med en enkel formel som delar massan av elementet (eller löst ämne) med massan av föreningen (eller lösningen).
Steg
Metod 1 av 2: Beräkna massprocent som vet massa
Bestäm ekvationen för procentandelen av massan i blandningen. Grundformeln för beräkning av massprocenten i blandningen är: massprocent = (kvalitetsmassa / blandad massa) x 100. Slutligen måste du multiplicera med 100 för att representera procentandelen.
- Skriv en ekvation när du börjar lösa problemet: massprocent = (substansmassa / blandad massa) x 100.
- Mängden kvalitet kommer att anges i problemet. Om ämnet inte ges, hänvisa till följande avsnitt om hur man hittar massprocent utan att veta vikter.
- Blandningens massa är lika med den totala massan av de ämnen som utgör blandningen eller lösningen.

Beräkna blandningens massa. När du väl känner till massorna av elementen eller föreningarna är allt du behöver göra att lägga till dem för att få massan av den slutliga blandningen eller lösningen. Detta är nämnaren i formeln för procentuell massa.- Exempel 1: Vad är massprocenten av 5 g natriumhydroxid när det löses upp med 100 g vatten?
- Blandningens massa är den totala massan av natriumhydroxid och vatten: 100 g + 5 g. Så den blandade vikten är 105g.
- Exempel 2: Vilken massa natriumklorid och vatten krävs för att bilda 175 g en 15% lösning?
- I det här exemplet, där du känner till den blandade massan och massprocenten, ber uppgiften att hitta massan av tillsatt löst ämne. Blandningens massa är 175 g.
- Exempel 1: Vad är massprocenten av 5 g natriumhydroxid när det löses upp med 100 g vatten?

Bestäm ämnets massa för att hitta den procentuella massan. När frågesporten frågar efter att hitta "massprocenten" för ett ämne, måste du hitta ämnets massa i procent av den totala massan av alla ingredienser. Skriv ner ämnets massa för att hitta den procentuella massan. Detta är täljaren i formeln för procentuell massa.- Exempel 1: Massan av natriumhydroxid (substans som kan hittas med massfraktion) är 5 g.
- Exempel 2: I det här exemplet letar mängden ämne efter procentandelen av den okända massan och du letar efter den.

Ersätt variablerna med massprocentandelsekvationen. När du väl har bestämt värdet för varje variabel, kopplar du bara in dem i ekvationen.- Exempel 1: massprocent = (substansmassa / blandad massa) x 100 = (5 g / 105 g) x 100.
- Exempel 2: Vi måste konvertera massprocentsekvationen för att beräkna kvantiteten av okänd kvalitet: kvalitetsmassa = (procentmassa * blandad massa) / 100 = (15 * 175) / 100 .
Beräkna volymprocenten. Nu när ekvationen är fylld behöver du bara beräkna massprocenten. Dela ämnets massa med blandningens massa och multiplicera den sedan med 100. Detta är massprocenten av ämnet i blandningen.
- Exempel 1: (5/105) x 100 = 0,04761 x 100 = 4,761%. Därför är massprocenten 5 g natriumhydroxid upplöst i 100 g vatten 4 761%.
- Exempel 2: Ekvationen efter konvertering för att beräkna kvantiteten kvalitet är (procentuell massa * blandad vikt) / 100: (15 * 175) / 100 = (2625) / 100 = 26,25 gram natriumklorid.
- Vikten av tillsatt vatten är blandningens vikt minus ämnets vikt: 175 - 26,25 = 148,75 gram vatten.
Metod 2 av 2: Beräkna massprocenten när massan är okänd
Bestäm ekvationen för procentandelen av massan i föreningen. Grundformeln för beräkning av massprocenten i en förening är: massprocent = (elementär molmassa / föreningens molmassa) x 100. Elementär molmassa är massan av en mol element medan molekylmassan är massan av en mol förening. Slutligen måste du multiplicera med 100 för att få procentvärdet.
- Skriv en ekvation när du börjar lösa problemet: massprocent = (elementär molmassa / molmassa av förening) x 100.
- Enheterna med ovanstående två värden är gram per mol (g / mol).
- När problemet inte ger massa kan du använda molmassan för att beräkna massens procentandel av elementet.
- Exempel 1: Beräkna massprocenten väte i en vattenmolekyl.
- Exempel 2: Beräkna massprocenten kol i en glukosmolekyl.
Skriva Kemisk formel. Om problemet inte täcker kemiska formler för varje förening måste du skriva ner dem. Om problemet är med den kemiska formeln, hoppa över det här steget och gå till steget "Hitta massan för varje element".
- Exempel 1: Skriv den kemiska formeln för vatten, H2O.
- Exempel 2: Skriv den kemiska formeln för glukos, C6H12O6.
Hitta massan för varje element i föreningen. Slå upp molekylvikten för varje element i den kemiska formeln i det periodiska systemet. Elementmassan skrivs vanligtvis under den kemiska symbolen. Skriv ner massan för varje element i föreningen.
- Exempel 1: Vi kan upptäcka att syreatom är 15 9994; och den kubiska väteatomen är 1 0079.
- Exempel 2: Vi fann att kolatommassan är 12 0107; syre är 15,9994; och väte är 1,0079.
Multiplicera den kubiska atomen med molförhållandet. Bestäm antalet mol (molförhållande) för varje element i den kemiska föreningen. Molförhållandet beräknas med det lilla antalet nedan i föreningens kemiska formel. Multiplicera den kubiska atomen för varje element med molförhållandet.
- Exempel 1: Väte har ett underskrift på två medan syre har ett underskrift på 1. Så multiplicera vätens molekylvikt med 2, 1 00794 X 2 = 2 01588; och den molekylära massan av syre är 15 9994 (multiplicerat med en).
- Exempel 2: Kol har ett underskrift på 6, väte är 12 och syre är 6. Multiplicera den kubiska atomen i varje element med indexet nedan.
- Kol (12,0107 * 6) = 72,0642
- Väte (1,00794 * 12) = 1209528
- Syre (15,9994 * 6) = 95,9964
Beräkna den totala massan av föreningen. Lägg till massorna av alla element i föreningen. Du kan beräkna den totala massan av föreningar med hjälp av massorna beräknade som molförhållanden. Detta tal kommer att vara nämnaren i procentmassaekvationen.
- Exempel 1: Tillsätt 2,01588 g / mol (massan av två mol väteatomer) till 15,9994 g / mol (massan av en mol syreatomer) ger 18,01528 g / mol.
- Exempel 2: Lägg till alla vikter tillsammans: kol + väte + syre = 72 06642 + 1209528 + 95 9964 = 180 156 g / mol.
Bestäm den grundmassa som massprocenten ska beräknas till. När problemet ber om "massprocent" betyder det att du måste hitta massan för ett visst element i föreningen som en procentandel av den totala massan för alla element. Bestäm och skriv ner massan av elementet. Denna massa är massan uttryckt i molförhållande. Detta tal är täljaren för procentmassaekvationen.
- Exempel 1: Massan av väte i en förening är 201588 g / mol (massan av två mol väteatomer).
- Exempel 2: Massan av kol i en förening är 72 0642 g / mol (massan av sex mol kolatomer).
Ersätt variablerna i massprocentandelsekvationen. Efter att ha bestämt värdena för varje variabel, ersätt dem helt enkelt med ekvationen som identifierades i det första steget: massprocent = (elementär molmassa / föreningens molmassa) x 100 .
- Exempel 1: massprocent = (elementär molmassa / föreningens molmassa) x 100 = (2,1588 / 18,1528) x 100.
- Exempel 2: massprocent = (elementär molmassa / föreningens molmassa) x 100 = (72 06642/180 156) x 100.
Beräkna volymprocenten. Nu när ekvationen är fylld behöver du bara beräkna massprocenten. Dela massan av elementet med den totala massan av föreningen och multiplicera den sedan med 100. Detta är procentandelen av massan av elementet i föreningen.
- Exempel 1: massprocent = (2,01588 / 18,01528) x 100 = 0,111189 x 100 = 11,18%. Således är massprocenten av väteatomen i vattenmolekylen 11,18%.
- Exempel 2: massprocent = (elementär molmassa / föreningens molmassa) x 100 = (72 06642/180 156) x 100 = 0,4000 x 100 = 40,00%. Så massprocenten av kolatomen i glukosmolekylen är 40,00%.