Författare:
Lewis Jackson
Skapelsedatum:
12 Maj 2021
Uppdatera Datum:
1 Juli 2024
Innehåll
Elektronkonfiguration av en atom är en serie siffror som representerar elektronorbitalerna. Elektronobitaner är de rumsliga regionerna med olika former som omger en atoms kärna, där elektroner är ordnade på ett ordnat sätt. Genom elektronkonfiguration kan du snabbt bestämma hur många elektronorbitaler som finns i atomen, och antalet elektroner i varje omlopp. När du förstår de grundläggande principerna för elektronkonfiguration kommer du att kunna skriva din egen elektronkonfiguration och kunna göra kemiska tester med tillförsikt.
Steg
Metod 1 av 2: Bestäm antalet elektroner med hjälp av ett kemiskt periodiskt system
Hitta atomens atomnummer. Varje atom har ett specifikt antal elektroner associerade med sig. Leta upp elementet i det periodiska systemet. Atomtalet är ett positivt heltal som börjar vid 1 (för väte) och ökas med 1 för varje atom därefter. Atomtalet är antalet atoner i atom - så det är också antalet elektroner i atomen i marktillståndet.
- Bestäm atomens laddning. En elektriskt neutral atom har rätt antal elektroner som visas i det periodiska systemet. En atom med en laddning kommer dock att ha mer eller mindre elektroner baserat på dess laddningsstorlek. Om du arbetar med atomer med en laddning, lägg till eller subtrahera motsvarande antal elektroner: lägg till en elektron för varje negativ laddning och subtrahera en elektron för varje positiv laddning.
- Till exempel kommer en natriumatom med en laddning av +1 att ta bort en elektron från basatomnummer 11. Därför kommer natriumatomen att ha totalt 10 elektroner.
- Memorera den grundläggande orbitalistan. När en atom tar emot elektroner kommer dessa elektroner att ordnas i orbitaler i en specifik ordning. När elektronerna fyller orbitaler är antalet elektroner i varje banor jämnt. Vi har följande orbitaler:
- Obitan s (valfritt nummer med ett "s" bakom i elektronkonfigurationen) har bara en omlopp, och följ Principen om undantag från PauliVarje orbital innehåller maximalt 2 elektroner, så varje orbital innehåller endast 2 elektroner.
- Obitan s har 3 orbitaler, så den kan rymma upp till 6 elektroner.
- Obitan d har 5 orbitaler, så den kan rymma upp till 10 elektroner.
- Obitan f har 7 orbitaler, så kan rymma upp till 14 elektroner. Memorera orbitalernas ordning enligt följande fångande mening:
Spå Paggressiv Duh FOkej Gstel HHoppsan ÍKJag kommer.
För atomer med fler elektroner fortsätter orbitaler att skrivas alfabetiskt efter bokstaven k, vilket gör att de tecken som användes utelämnas.
- Förstå elektronkonfiguration. Elektronkonfigurationer är skrivna för att tydligt visa antalet elektroner i atomen, liksom antalet elektroner i varje omlopp. Varje omlopp skrivs i en viss ordning, med antalet elektroner i varje omlopp skrivet ovan till höger om orbitalnamnet. Slutligen är elektronkonfigurationen en sekvens som består av namnen på orbitalerna och antalet elektroner skrivna ovan till höger om dem.
- Följande exempel är en enkel elektronkonfiguration: 1s 2s 2p. Denna konfiguration visar att det finns två elektroner i 1s-omloppet, två elektroner i 2-omloppet och sex elektroner i 2p-omloppet. 2 + 2 + 6 = 10 elektroner (totalt). Denna elektronkonfiguration är för en elektriskt neutral neonatom (neons atomnummer är 10).
- Memorera ordningen för orbitaler. Observera att orbitalerna är numrerade enligt elektronklassen, men är energiskt ordnade. Till exempel är 4s mättad med en lägre energi (eller mer hållbar) än den mättade eller omättade 3d-banan, så 4s-underklassen skrivs först. När du väl känner till orbitalernas ordning kan du ordna elektronerna i dem enligt antalet elektroner i atomen. Ordern för att placera elektroner i orbitaler är följande: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- Elektronkonfigurationen för en atom med varje elektronfylld bana skrivs som: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Observera att om alla skikt är fyllda är ovanstående elektronkonfiguration den för Og (Oganesson), 118, som är den högst numrerade atomen i det periodiska systemet - som innehåller alla för närvarande kända elektronskikt för med en elektriskt neutral atom.
- Sortera elektroner i orbitaler enligt antalet elektroner i atomen. Om du till exempel vill skriva elektronkonfigurationen för den elektriskt neutrala kalciumatomen är det första du ska göra att hitta dess atomnummer i det periodiska systemet. Atomantalet kalcium är 20, så vi skriver konfigurationen av en atom med 20 elektroner i ordningen ovan.
- Sätt dina elektroner i orbitaler i ordningen ovan tills du har nått 20 elektroner. Obitan 1s får två elektroner, 2s får två, 2p får sex, 3s får två, 3p får sex och 4s får två (2 + 2 + 6 +2 +6 + 2 = 20). Därför är elektronkonfigurationen för kalcium: 1s 2s 2p 3s 3p 4s.
- Obs! Energinivån ändras när elektronskiktet ökar. Till exempel, när du skriver till den fjärde energinivån skrivs 4-underklassen först, senare till 3d. När du har skrivit den fjärde energinivån kommer du att gå vidare till den femte nivån och starta om lagringsordningen. Detta händer bara efter den tredje energinivån.
- Använd det periodiska systemet som en visuell genväg. Du kanske har märkt att formen på det periodiska systemet motsvarar ordningen på orbitaler i elektronkonfigurationen. Till exempel slutar alltid atomer i den andra vänstra kolumnen vid "s", atomer längst till höger i mittavsnittet slutar alltid med "d", etc. Använd det periodiska systemet för att skriva strukturer. figur - ordningen i vilken elektronerna placeras i orbitaler kommer att motsvara de positioner som visas i det periodiska systemet. Se nedan:
- De två kolumnerna längst till vänster är atomer vars elektronkonfiguration slutar i s orbital, den högra delen av det periodiska systemet är atomer med en elektronkonfiguration som slutar i p orbital, den mellersta delen är atomer som slutar i s orbital. d, och nedan är atomerna som slutar i f orbitalen.
- Till exempel, när du skriver en elektronkonfiguration av grundämnet klor, gör följande argument: Atomen finns i tredje raden (eller "period") i det periodiska systemet. Det finns också i den femte kolumnen i p-orbitalblocket på det periodiska systemet. Så elektronkonfigurationen kommer att hamna ... 3p.
- Försiktig! D- och f-orbitalklasserna i det periodiska systemet motsvarar energinivåer som skiljer sig från deras period. Till exempel motsvarar den första raden i d-orbitalblocket 3d-banan trots att den är i period 4, medan den första raden i f-orbitalet motsvarar 4f-banan trots att den är i period 6.
- Lär dig hur man skriver hopfällbara elektronkonfigurationer. Atomerna längs den högra kanten av det periodiska systemet kallas sällsynt gas. Dessa element är kemiskt mycket inerta. För att förkorta sättet att skriva långa elektronkonfigurationer, skriv i kemisk hakparentes den kemiska symbolen för närmaste sällsynta gas som har färre elektroner än atomens och fortsätt sedan att skriva elektronkonfigurationerna för nästa orbitaler. . Se nedan:
- För att förstå detta koncept, skriv ett exemplets kollapsade elektronkonfiguration. Antag att vi måste skriva elektronkonfigurationen för zinkreduktion (atomnummer 30) genom en sällsynt gaskonfiguration. Zinks fullständiga elektronkonfiguration är: 1s 2s 2p 3s 3p 4s 3d. Observera dock att 1s 2s 2p 3s 3p är konfigurationen för den sällsynta agongasen. Byt bara ut den här delen av zinks elektronnotation med den agoniska kemiska symbolen inom hakparenteser ().
- Därför är zinkens elektronkonfiguration kompakt 4s 3d.
Metod 2 av 2: Använda det periodiska systemet ADOMAH

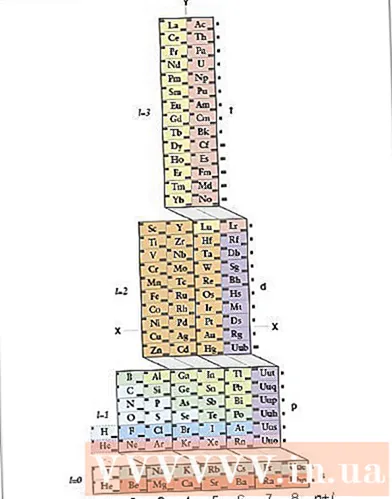
Utforska ADOMAH periodiska tabell. Denna metod för att skriva elektronkonfiguration kräver inte memorering. Emellertid kräver denna metod en omarrangerad periodisk tabell, eftersom i en vanlig periodisk tabell, sedan den fjärde raden, motsvarar inte antalet cykler elektronskiktet. Hitta ett ADOMAH Periodic Table, ett speciellt kemiskt periodiskt system designat av forskaren Valery Tsimmerman. Du hittar den här periodiska tabellen på internet.- På det periodiska systemet ADOMAH är de horisontella raderna grupper av element såsom halogener, inerta gaser, alkalimetaller, jordalkalimetaller etc. De vertikala kolumnerna motsvarar elektronskiktet och kallas "steg" (diagonala korsningar). block s, p, d och f) motsvarar perioden.
- Helium är ordnat bredvid väte eftersom båda har en unik 1s-omlopp. De periodiska blocken (s, p, d och f) visas på höger sida och antalet elektronskikt visas vid basen. Elementnamn skrivs i en rektangel numrerad från 1 till 120. Dessa siffror är vanliga atomnummer, som representerar det totala antalet elektroner i en elektriskt neutral atom.
- Hitta element i det periodiska systemet ADOMAH. För att skriva en elektronkonfiguration av ett element, lokalisera dess symbol på ADOMAH Periodic Table och stryka bort alla element med högre atomnummer. Om du till exempel vill skriva elektronkonfigurationen för eribi (68), korsa över elementen 69 till 120.
- Notera siffrorna 1 till 8 längst ner i det periodiska systemet. Detta är antalet elektronskikt eller kolumner. Var inte uppmärksam på kolumner som bara har strykt över element.För eribi är de återstående kolumnerna 1, 2, 3, 4, 5 och 6.
- Räkna antalet orbitaler till atomens position för att skriva konfigurationen. Titta på blocksymbolen som visas till höger om det periodiska systemet (s, p, d och f) och titta på antalet kolumner som visas vid basen av tabellen, oavsett diagonala linjer mellan block, dela kolumner i kolumnblock och skriv de är i ordning från botten till toppen. Ignorera kolumnblock som endast innehåller streckade element. Skriv ner kolumnblock som börjar med kolumnnumret och sedan blocksymbolen så här: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (i fallet med eribi).
- Obs! Ovanstående elektronkonfiguration för Er skrivs i stigande ordning av antalet elektronskikt. Denna konfiguration kan också skrivas i ordningen för att placera elektroner i orbitaler. Följ stegen från topp till botten istället för kolumner när du skriver kolumnblock: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- Räkna antalet elektroner per omlopp. Räkna antalet elektroner som inte är överkorsade i varje kolumnblock, tilldela en elektron per element och skriv antalet elektroner bredvid blocksymbolen för varje blockkolumn, så här: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. I detta exempel är detta elektronkonfigurationen för eribi.
- Känna igen onormala elektronkonfigurationer. Det finns arton vanliga undantag från elektronkonfigurationen för atomer i det lägsta energitillståndet, även känt som jordtillståndet. Jämfört med den allmänna tumregeln avviker de bara från de två sista till tre elektronpositionerna. I detta fall orsakar den faktiska elektronkonfigurationen elektronerna att ha ett lägre energitillstånd än atomens standardkonfiguration. De ovanliga atomerna är:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) och Centimeter (..., 5f7, 6d1, 7s2).
Råd
- När atomen är en jon betyder det att antalet protoner inte är lika med antalet elektroner. Atomens laddning visas sedan i det (vanligtvis) övre högra hörnet av elementets symbol. Därför kommer en antimonatom med laddning +2 att ha en elektronkonfiguration av 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Observera att 5p ändras till 5p. Var försiktig när konfigurationen av en elektriskt neutral atom slutar i andra orbitaler än s och p. Med borttagna elektroner kan du bara ta elektroner från valensorbitalerna (s- och p-orbitalerna). Så om en konfiguration slutar vid 4s 3d, och atomen har en laddning på +2, ändras konfigurationen till 4s 3d. Vi ser 3dkonstant, men endast elektroner i s orbital tas bort.
- Alla atomer tenderar att återgå till ett stabilt tillstånd, och den mest stabila elektronkonfigurationen kommer att ha tillräckligt med s och p-orbitaler (s2 och p6). Dessa sällsynta gaser har denna elektronkonfiguration, varför de sällan deltar i reaktioner och är på höger sida av det periodiska systemet. Så om en konfiguration slutar vid 3p, behöver den bara lägga till ytterligare två elektroner för att bli stabila (att ge bort sex elektroner, inklusive de i s orbital, kommer att kräva mer energi, så att ge bort fyra elektroner skulle vara lätt. lättare). Om en konfiguration slutar vid 4d behöver den bara ge bort tre elektroner för att nå ett stabilt tillstånd. På samma sätt är de nya underklasserna som tar emot hälften av elektronerna (s1, p3, d5 ..) mer stabila, t.ex. p4 eller p2, men s2 och p6 kommer att vara ännu mer stabila.
- Du kan också använda valenselektronkonfigurationen för att skriva elektronkonfigurationen för ett element, vilket är de sista s- och p-orbitalerna. Därför är valenskonfigurationen för en antimonatom för ett antimon 5s 5p.
- Joner gillar inte det eftersom de är mycket mer hållbara. Hoppa över de två ovanstående stegen i den här artikeln och arbeta på samma sätt, beroende på var du börjar och hur många eller mindre elektroner du har.
- För att hitta atomnumret från sin elektronkonfiguration, lägg till alla siffror som följer bokstäverna (s, p, d och f). Detta är bara korrekt om det är en neutral atom, om det är en jon kan du inte använda den här metoden. Istället måste du lägga till eller subtrahera antalet elektroner du tar in eller ger bort.
- Siffran efter bokstaven måste skrivas i det övre högra hörnet, du får inte skriva fel när du tar testet.
- Det finns två olika sätt att skriva elektronkonfigurationer. Du kan skriva i stigande ordning för elektronskiktet, eller i den ordning elektronerna placeras i orbitaler, som visas för eribi-atomen.
- Det finns tillfällen där en elektron måste "skjutas upp". Det är när en orbital bara har en elektron som saknas för att ha hälften eller alla elektroner, då måste du ta en elektron från närmaste s- eller p-orbital för att överföra den till den orbital som behöver den elektronen.
- Vi kan inte säga att "energifraktionsstabiliteten" i underklassen tar emot hälften av elektronerna. Det är en överförenkling. Anledningen till den stabila energinivån för den nya underklassen som tar emot "hälften av antalet elektroner" är att varje omlopp bara har en enda elektron, så elektron-elektronavstötningen minimeras.